Triastek riceve l’autorizzazione FDA IND per il prodotto stampato in 3D di Blockbuster MoleculeTriastek, Inc. (“Triastek”) ha recentemente annunciato che la Food and Drug Administration (FDA) degli Stati Uniti ha concesso il permesso di iniziare gli studi clinici sul suo Investigational New Drug (IND) Domanda 505(b)(2) per un prodotto farmaceutico stampato in 3D – T20. È il secondo prodotto di Triastek che riceve l’autorizzazione IND dalla FDA.
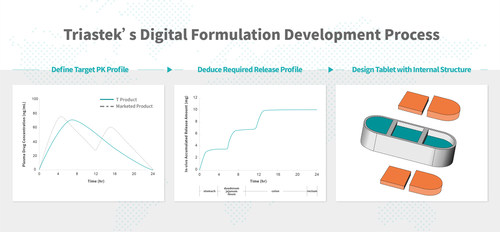
Processo di sviluppo della formulazione digitale di Triastek (PRNewsfoto/Triastek, Inc.)
T20 fornisce un dosaggio una volta al giorno pur essendo previsto per mantenere lo stesso profilo di efficacia e di effetti avversi e migliorare l’aderenza. Il prodotto attualmente commercializzato viene somministrato due volte al giorno per il trattamento dei disturbi cardiovascolari e della coagulazione e negli ultimi anni è stato ai vertici delle vendite globali o quasi. Seguendo il percorso 505(b)(2), T20 dovrebbe fornire una formulazione che affronti le esigenze dei pazienti non soddisfatte migliorando l’aderenza e quindi l’opportunità di migliorare i risultati dei pazienti.
La formulazione T20 una volta al giorno viene sviluppata utilizzando il processo di sviluppo della formulazione digitale e l’esclusiva tecnologia di rilascio programmato di farmaci sperimentata da Triastek. Utilizzando il metodo della formulazione di stampa 3D di Triastek (3DFbD ® ), a partire dal profilo PK a rilascio prolungato desiderato, viene previsto il profilo tempo/posizione di dissoluzione del tratto gastrointestinale (GIT) richiesto utilizzando un modello biofarmaceutico fisiologico (PBBM) di Assorbimento GIT per informare lo sviluppo della formulazione. Da ciò, la geometria interna della compressa può essere creata utilizzando la deposizione per estrusione a fusione di Triastek (MED ®) Tecnologia di stampa 3D per ottenere il profilo di rilascio desiderato e la farmacocinetica del farmaco risultante. Questo processo innovativo ed efficiente supera molti dei limiti dello sviluppo e della produzione tradizionali di prodotti a rilascio prolungato. La prova del concetto è già stata dimostrata in studi sugli animali utilizzando una formulazione prototipo di T20.
Triastek è una nuova società di piattaforme tecnologiche farmaceutiche per la stampa 3D con tecnologie proprietarie che comprendono la progettazione di forme di dosaggio, lo sviluppo di prodotti farmaceutici digitali e la produzione intelligente. Utilizzando queste tecnologie, Triastek sviluppa la propria pipeline di prodotti e co-sviluppa prodotti con partner di aziende farmaceutiche multinazionali e cinesi utilizzando entrambi i percorsi normativi 505(b)(1) e 505(b)(2). Applicare il loro MED ® Tecnologia di stampa 3D, Triastek può sviluppare nuove formulazioni che sono difficili da ottenere con la tecnologia delle forme di dosaggio convenzionali per affrontare le esigenze cliniche non soddisfatte e migliorare i risultati della terapia farmacologica. Concentrandosi inizialmente su farmaci di successo a piccole molecole, il loro sviluppo dimostrerà l’utilità della nuova tecnologia di sviluppo di prodotti farmaceutici di Triastek e delle capacità di produzione continua di GMP.
Il Dr. Senping Cheng , fondatore e CEO di Triastek, ha dichiarato: “Di solito ci vogliono 30 anni perché una tecnologia farmaceutica emergente completi il suo viaggio dal concetto iniziale al mercato. La tecnologia di stampa 3D applicata allo sviluppo di prodotti farmaceutici è stata esplorata per oltre 26 anni anni. L’autorizzazione FDA IND di T20 è una pietra miliare significativa per Triastek e dimostra i significativi progressi nella stampa 3D di prodotti farmaceutici”.