l modello di tessuto umano biostampato consente la ricerca senza test sugli animali
Guarda crescere il tumore
28 per 21 millimetri: questa è la dimensione del chip in plexiglas su cui il team guidato da Michael Ausserlechner e Judith Hagenbuchner osserva un piccolo tumore crescere direttamente nel tessuto. I ricercatori del primo laboratorio di bioprinting 3D dell’Austria utilizzano il loro strumento di recente sviluppo per esaminare lo sviluppo dei tumori, ma anche l’efficacia dei farmaci antitumorali in modalità live: il tessuto umano replicato dalla biostampante 3D lo rende possibile.
Immagine per la stampa gratuita per il download: (c) Bioprinting Lab /D. Didascalia Nothdurfter
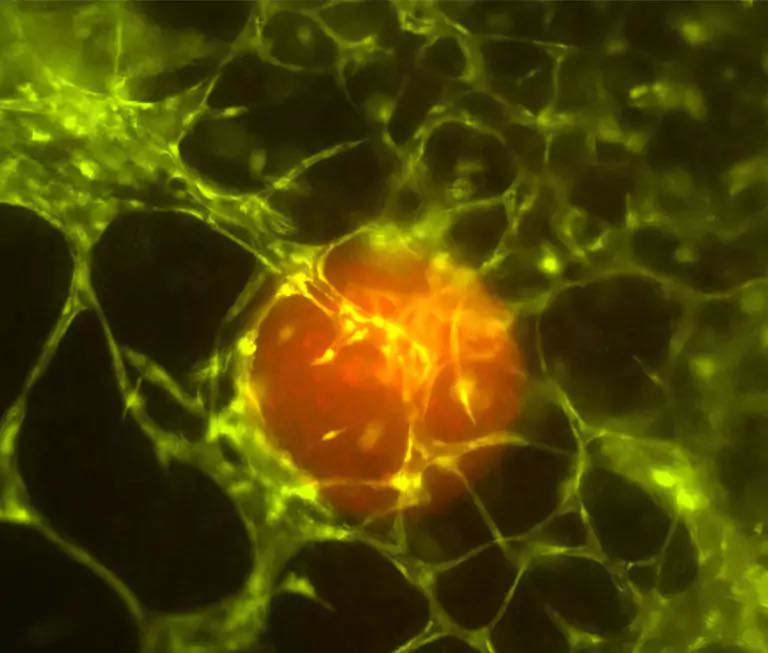
: Immagine del tumore: Sfera tumorale fluorescente rossa in tessuto biostampato.
Video: Bioprinting 3D: Osservare la crescita del tumore:
Anche se il modello 3D del microambiente tumorale – un “chip fluidico” con sopra un pezzo di tessuto spesso tre millimetri – non merita la descrizione di “artificiale”. Perché il modello, che è stato sviluppato dai ricercatori Daniel Nothdurfter, Judith Hagenbuchner e Michael Ausserlechner dell’Università di Medicina di Innsbruck ed è già stato brevettato, cresce da solo e in modo del tutto naturale. Queste condizioni quasi reali sono un grande vantaggio quando si studia in dettaglio come il tumore manipola il suo ambiente e lo usa per se stesso. Gli altri vantaggi: l’equivalente derivato da tessuto umano può essere prodotto in modo standardizzato e rende gli esperimenti sugli animali sostituibili. La rivista Biofabbricazionerelazioni sui risultati promettenti.
I ricercatori di Innsbruck hanno inserito sferoidi tumorali (aggregati di cellule tumorali sferiche, Nota:) da un neuroblastoma – uno dei tumori solidi più comuni nei bambini piccoli – viene posizionato tra le cellule del tessuto, dove cresce in un microtumore entro due o tre settimane. “Quindi siamo stati in grado di osservare come questo piccolo tumore estrae i capillari dal tessuto e questi poi crescono nel tumore. Il tumore costruisce così la propria struttura di approvvigionamento. Questo modello 3D ci aiuterà a comprendere meglio i meccanismi della cancerogenesi, ovvero la crescita del tumore, e quindi a rendere il microambiente tumorale più utilizzabile come bersaglio terapeutico per combattere il cancro – e senza esperimenti sugli animali”, sottolinea il microbiologo e capo di laboratorio Michael Ausserlechner.
Tridimensionale, senza animali e riproducibile
La novità di questo sviluppo del laboratorio di bioprinting 3D presso l’Università di Medicina di Innsbruck è la combinazione di tessuto vascolare complesso su un chip fluidico. Sebbene questi componenti microfluidici siano già in uso nel campo della coltivazione cellulare, di solito hanno solo uno strato cellulare. “Il nostro tessuto cresce in una rete tridimensionale fino a uno spessore di tre millimetri”, spiega il microbiologo Ausserlechner. In una prima fase, i canali sottili vengono laserati nei chip e un idrogel tridimensionale con cellule viene costruito con la biostampante in modo tale che i canali sottili nel tessuto siano collegati direttamente ai canali nel chip. Poiché il tessuto impiega dalle due alle tre settimane per crescere e maturare, le cellule al suo interno hanno il tempo di organizzarsi. Questo cambia anche il volume del tessuto e può staccarsi dalla plastica. “Abbiamo quindi sviluppato un design speciale per l’interblocco di tessuto e chip, in modo che il tessuto vivente rimanga stabile e ancorato per settimane”, afferma Ausserlechner, descrivendo la superiorità dello strumento innovativo.
I ricercatori di Innsbruck sono anche riusciti a far crescere sottili capillari simili a vasi sanguigni in modo che tutte le cellule in questo modello di tessuto possano essere adeguatamente rifornite. “I vasi che generiamo direttamente con la biostampante costituiscono le principali vie di approvvigionamento nel nostro modello di tessuto e hanno un diametro di circa 0,3 millimetri. Tuttavia, è necessario creare capillari sottili in modo che anche le cellule del tessuto che sono più lontane da questi canali siano rifornite di acqua. Abbiamo sviluppato uno speciale bio-inchiostro per questo, in cui le cellule endoteliali – rivestono l’interno dei vasi sanguigni – si organizzano spontaneamente insieme alle cellule staminali entro sei o sette giorni in una sottile rete capillare e permeano l’intero tessuto “. afferma la biotecnologa Judith Hagenbuchner, che gestisce e fonda insieme ad Ausserlechner il laboratorio di bioprinting 3D. Il processo messo in moto è simile alla guarigione naturale delle ferite.
Ampia gamma di applicazioni
L’usabilità del nuovo modello è aperta a molte domande. Ciò consente, ad esempio, di testare i cosiddetti inibitori dell’angiogenesi (l’angiogenesi è la formazione di nuovi vasi sanguigni, ndr ), un gruppo di farmaci che mira a sopprimere la formazione di nuovi vasi sanguigni e quindi la crescita del tumore. Possono essere esaminate anche domande orientate al paziente e quindi personalizzate, come la scelta della terapia appropriata. Il modello di tessuto biostampato compie quindi anche un passo importante nella direzione della medicina di precisione. Lo sviluppo di Innsbruck potrebbe anche rivelarsi una piattaforma adatta per la ricerca sulle metastasi, un processo che riduce significativamente le possibilità di una cura per il cancro.
Circa le persone:
Michael J. Ausserlechner ha studiato microbiologia all’Università di Innsbruck, ha conseguito il dottorato in biologia molecolare e si è abilitato in fisiopatologia all’Università di Medicina di Innsbruck. Dal 2003 dirige il Laboratorio di Biologia Molecolare di Pediatria I, dal 2018 il laboratorio di bioprinting 3D appena fondato insieme a Judith Hagenbuchner. La sua ricerca si concentra sui meccanismi di morte cellulare nel cancro infantile, sullo sviluppo di farmaci e sulle applicazioni “organo su chip” biostampate in 3D per i test antidroga.
Judith Hagenbuchner ha studiato biotecnologie presso l’Università di scienze applicate di Wels, ha conseguito il dottorato in biologia molecolare presso l’Università di Innsbruck e si è abilitata in fisiopatologia sperimentale presso l’Università di medicina di Innsbruck. È coinvolta nella respirazione mitocondriale e nel metabolismo, nonché nello sviluppo di bioreattori e modelli di tessuti biostampati per la ricerca sul cancro e sulle malattie rare.