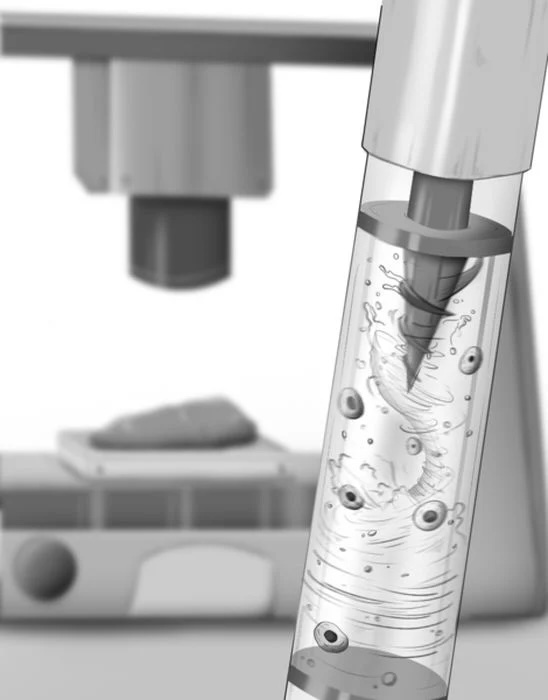
La biostampa 3D a estrusione deposita strati di idrogel (“bioink”) contenenti cellule attraverso un ugello. In questo scenario, la gravità può causare sedimentazione: le cellule, più dense del gel che le circonda, tendono a scendere nella siringa durante sessioni di stampa lunghe. L’effetto si traduce in distribuzione cellulare non uniforme, intasamenti dell’ugello e variabilità tra costrutti consecutivi, un limite rilevante quando si punta a protocolli ripetibili per modelli di malattia, screening farmacologico o tessuti ingegnerizzati.
Soluzioni esistenti e perché non bastano sempre
Pratiche come mescolare manualmente il bioink prima di caricarlo, oppure usare approcci di miscelazione “passiva”, non garantiscono omogeneità una volta iniziata l’estrusione: durante la stampa la sospensione continua a evolvere, soprattutto se i tempi si allungano o se si lavora con idrogel viscosi. In letteratura esistono anche sistemi con miscelatori statici (ad esempio in configurazioni multi-siringa), utili in alcuni contesti ma non pensati specificamente per contrastare la sedimentazione cellulare dentro una singola siringa durante estrusioni prolungate.
La proposta del MIT: che cos’è MagMix
Un gruppo del Massachusetts Institute of Technology (MIT) ha sviluppato MagMix, un dispositivo di miscelazione in-siringa pensato per mantenere il bioink omogeneo durante l’estrusione. L’obiettivo dichiarato è ridurre la sedimentazione cellulare senza richiedere cambiamenti alla formulazione del bioink e senza modifiche permanenti all’hardware della biostampante: in pratica, un modulo montabile sul sistema di estrusione esistente.
Come funziona: elica magnetica interna e magnete esterno in movimento
Il principio meccanico è composto da due parti: (1) una piccola elica/propeller con magnete inserita dentro la siringa, a contatto con il bioink; (2) un magnete permanente esterno montato vicino alla siringa e mosso su/giù da un attuatore, in modo da trascinare il movimento dell’elica interna e generare una miscelazione “dolce” e regolabile. La logica di controllo può essere implementata con componenti elettronici compatti (nel resoconto tecnico si cita un controllo via Arduino).
Progettazione e ottimizzazione: geometrie dell’elica e simulazioni
Per evitare zone morte nella siringa (specialmente verso la punta conica), il team ha iterato più geometrie dell’elica e ha impiegato simulazioni di fluidodinamica per scegliere forma e velocità di miscelazione. In una delle descrizioni tecniche, la geometria che performa meglio include un’estensione “a vite” capace di raggiungere la zona conica, migliorando l’uniformità di particelle/cellule lungo la sezione della siringa.
Risultati principali: 12 costrutti consecutivi e oltre 45 minuti di stampa
Nei test riportati, MagMix ha mantenuto una distribuzione cellulare più uniforme su 12 costrutti stampati in sequenza durante sessioni di circa 45 minuti (in un abstract tecnico si parla anche di circa 40 minuti), con una riduzione degli eventi di intasamento rispetto ai controlli non miscelati. È un punto importante perché, nelle stampe consecutive, la sedimentazione tende ad accumularsi e a rendere i campioni “iniziali” e “finali” molto diversi tra loro.
Effetto della velocità di miscelazione sulla vitalità cellulare
Un aspetto delicato è bilanciare omogeneizzazione e stress meccanico sulle cellule. In un resoconto che riporta numeri di vitalità a diverse velocità, la vitalità cellulare risulta 90,1% a bassa velocità, 82,1% a velocità intermedia e 65,5% ad alta velocità; di conseguenza, la scelta operativa ricade su settaggi più bassi/intermedi per contenere lo stress cellulare pur mantenendo l’efficacia di miscelazione.
Esempio di bioink e protocollo di stampa usato nelle prove (dettagli sperimentali)
In un abstract tecnico collegato al progetto, il bioink include mioblasti murini C2C12 in GelMA al 15% (wt/v) con 0,5% (wt/v) di LAP come fotoiniziatore. La stampa viene eseguita in modalità “embedded” in un bagno di supporto (con componenti quali Pluronic F-127, nanoclay Laponite-RDS e cloruro di calcio) e poi fotopolimerizzata con luce 405 nm per 1 minuto. La valutazione di distribuzione e vitalità avviene con test live/dead e microscopia confocale confrontando il primo e l’ultimo costrutto stampato.
Integrazione su bioprinters e fabbricazione del sistema
Sempre nello stesso abstract, MagMix è descritto come compatibile con la CELLINK Bio X e composto da elementi modulari (alloggiamento, eliche con magnete, ingranaggi per trasferire il moto), con parti realizzate tramite stampa 3D (si cita una Stratasys J35 per alcuni componenti) e un attuatore controllato via microcontrollore. L’impostazione “modulare” mira a rendere il sistema adattabile a siringhe di diverse dimensioni e a più configurazioni di estrusione.
Perché conta: ripetibilità, modelli biologici e interesse per alternative ai test animali
Il vantaggio pratico dichiarato è aumentare la ripetibilità dei tessuti biostampati, condizione necessaria per usarli come modelli in cui confrontare farmaci o fenomeni patologici con variabilità controllata. Nel contesto regolatorio, negli Stati Uniti la FDA sta promuovendo lo sviluppo e l’adozione di New Approach Methodologies (NAMs) per la valutazione di sicurezza/efficacia, includendo modelli in vitro più informativi e riducendo la dipendenza dai test su animali; soluzioni che migliorano standardizzazione e qualità dei costrutti possono inserirsi in questa traiettoria.
Limiti pratici e prossimi passi
I risultati disponibili evidenziano una finestra sperimentale nell’ordine di decine di minuti e un numero definito di costrutti consecutivi; una sfida naturale sarà verificare prestazioni su stampe più lunghe, su geometrie più grandi e su bioink con proprietà reologiche differenti. Nella descrizione tecnica si indica anche un percorso verso costrutti di scala maggiore e applicazioni in medicina rigenerativa, mantenendo al centro l’esigenza di miscelazione omogenea senza penalizzare la vitalità cellulare.