Bioprinting 3D in vivo non invasivo da advances.sciencemag.org
Astratto
La tecnologia di stampa tridimensionale (3D) ha un grande potenziale nell’avanzamento della medicina clinica. Attualmente, le strategie di applicazione in vivo per i prodotti macroscale stampati in 3D sono limitate all’impianto chirurgico o alla stampa 3D in situ al trauma esposto, entrambi richiedono un’esposizione del sito di applicazione. Qui, mostriamo una tecnologia di stampa 3D basata sulla fotopolimerizzazione digitale a infrarossi vicini (NIR) (DNP) che consente la bioprinting 3D in vivo non invasiva di costrutti di tessuto. In questa tecnologia, il NIR è modulato in un modello personalizzato da un dispositivo digitale a micromirror e proiettato dinamicamente per indurre spazialmente la polimerizzazione di soluzioni monomeriche. Per irradiazione ex vivo con il NIR modellato, il bioink iniettato per via sottocutanea può essere stampato in modo non invasivo in costrutti di tessuto personalizzati in situ. Senza impianto chirurgico, sono stati ottenuti in vivo un tessuto personalizzato simile all’orecchio con condrificazione e un’impalcatura conforme riparabile caricata con cellule di tessuto muscolare. Questo lavoro fornisce una prova del concetto di bioprinting 3D in vivo non invasivo.
INTRODUZIONE
La tecnologia di stampa tridimensionale (3D), una tecnologia di produzione additiva avanzata, presenta vantaggi nel fabbricare strutture personalizzate o complesse con ampie applicazioni mediche. Il bioprinting, ovvero l’uso di cellule contenenti bioink per stampare in 3D ostacoli viventi come tessuti o organi, ha un grande potenziale nel far progredire la medicina, specialmente nella medicina della rigenerazione ( 1 – 5 ). Attualmente, i sistemi di bioprinting 3D comunemente usati includono la stampa a getto d’inchiostro ( 6 , 7 ), la stampa di estrusione ( 8 ), la stampa assistita da luce ( 3 , 9 – 12 ) e la scrittura diretta laser ( 13). Attualmente, le strategie di applicazione in vivo per i prodotti macroscale stampati in 3D sono limitate all’impianto chirurgico o alla stampa 3D in situ al trauma esposto, entrambi richiedono un’esposizione del sito di applicazione. Tuttavia, una tendenza importante dei trattamenti clinici è l’approccio minimamente invasivo o non invasivo ( 14 , 15). Per le lesioni interne sotto la pelle, la chirurgia che espone un trauma danneggerebbe i tessuti circostanti, causando una lesione secondaria. Nel frattempo, per la chirurgia plastica, i metodi non invasivi sono molto desiderati. Questi importanti requisiti clinici non possono essere soddisfatti dalle tecnologie di stampa 3D esistenti, motivandoci a sviluppare tecnologie di stampa 3D non invasive che possono fabbricare in modo non invasivo il bioink ricoperto di tessuto in prodotti personalizzati, compresi i costrutti di tessuto vivente in situ.
La tecnologia di bioprinting 3D basata sull’elaborazione della luce digitale (DLP), un metodo di bioprinting assistito dalla luce, ha attirato molta attenzione negli ultimi decenni per la sua elevata vitalità delle celle di post-stampa e velocità e risoluzione di stampa superiori ( 3 , 9 , 10 ). Attualmente, è stato razionalmente utilizzato per la ricostruzione o la riparazione di più tessuti, incluso il midollo spinale ( 3 ), il nervo periferico ( 16 ) e la lesione dei vasi sanguigni ( 17). Convenzionalmente, la luce ultravioletta (UV) o blu viene sfruttata per aiutare la bioprinting tramite fotopolimerizzazione. Tuttavia, è difficile utilizzare la luce UV o blu come strumento per la produzione non invasiva a causa della scarsa capacità di penetrazione dei tessuti. La luce a infrarossi vicini (NIR) può penetrare nei tessuti profondi ed è stata utilizzata per il rilascio controllato di farmaci ( 18 ), terapia fotodinamica ( 19 ), terapia fototermica ( 20 ), imaging in vivo ( 21 ), visualizzazione di immagini 3D ( 22 ), e optogenetica in vivo ( 23). Inoltre, simile alla luce UV o blu, la luce NIR ha il potenziale per iniziare la fotopolimerizzazione. La fotopolimerizzazione indotta da NIR fornisce un metodo trasformativo per la fabbricazione non invasiva in vivo. Il controllo preciso della fotopolimerizzazione indotta dalla NIR consente la fabbricazione non invasiva del bioink ricoperto di tessuto in prodotti strutturati, con potenziale applicazione nella ricerca clinica o medica. In questo studio, sulla base della progettazione di un processo di fotopolimerizzazione digitale NIR (DNP), sviluppiamo un sistema di bioprinting 3D in vivo non invasivo. In questo sistema, introducendo un modello CAD (computer-aided design), il NIR digitale viene generato dinamicamente dal chip del dispositivo di micromirror digitale (DMD) collegato e proiettato tempestivamente per indurre in modo non invasivo la polimerizzazione spaziale del bioink iniettato locale strato per strato. Senza impianto chirurgico, i costrutti personalizzati di tessuti viventi sono stati generati con successo nel corpo. Questo lavoro aprirà una nuova strada per la ricerca sulla stampa 3D e farà avanzare il campo della medicina non invasiva.
RISULTATI
Sfruttando la buona penetrazione nei tessuti della luce NIR, abbiamo progettato una tecnologia di stampa 3D non invasiva basata sul processo DNP, come mostrato schematicamente in Fig. 1 . In questa tecnologia, il fascio di luce NIR è tempestivamente modulato da un DMD, successivamente proiettato in un modello personalizzato per obiettivo. Il NIR modellato penetra attraverso la pelle per indurre la polimerizzazione spaziale delle cellule contenenti soluzione monomerica iniettata per via sottocutanea. Tramite un nanoiniziatore, i monomeri di idrogel biocompatibili comunemente usati come la gelatina metacriloile (GelMA) possono essere iniziati in modo efficiente per la polimerizzazione in irradiazione NIR. Dopo che le immagini sono state inviate al computer in sequenza, la soluzione di monomero contenente cellule come bioink può essere stampata in modo non invasivo in costrutti di tessuto personalizzati in vivo.
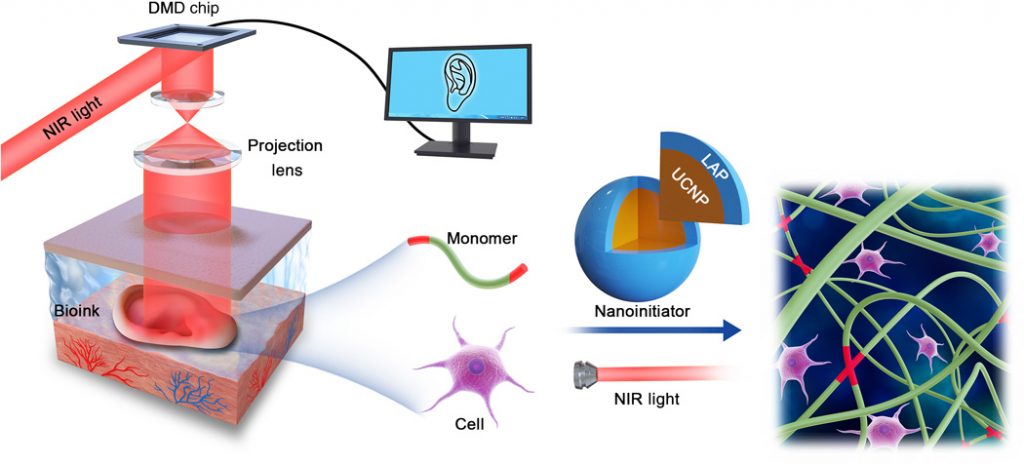
Fig. 1 Schema di bioprinting 3D non invasivo basato su DNP.
I dati di un modello CAD personalizzato sono stati inviati nel chip DMD tramite un computer di controllo. La luce NIR da 980 nm con un motivo ottico è stata proiettata attraverso la lente ottica e il tessuto sul bioink, che è stato iniettato nel corpo per fabbricare in modo non invasivo un tessuto vivente in vivo. Il bioink contiene nanoiniziatori UCNP @ LAP che possono convertire la luce NIR in luce a 365 nm e quindi avviare la polimerizzazione ottica controllata di monomeri.
Nanoiniziatori per polimerizzazione indotta da NIR
Nel processo DNP, un nanoiniziatore, cioè una nanoparticella di conversione verso l’alto (UCNP) ( 24 ) rivestita con fotoiniziatore UV / luce blu (PI) litio fenil-2,4,6-trimetilbenzoilfosfinato (LAP) ( 25 ), era progettato e chiamato UCNP @ LAP. Il design è stato motivato dal fatto che il nanoiniziatore che fornisce fotoni UV ad alta conversione emessi da UCNP sotto irradiazione NIR è stato assorbito dal LAP per avviare la polimerizzazione dei monomeri fotosensibili e per evitare l’effetto dannoso UV sulle cellule. Dopo l’ottimizzazione delle composizioni elementali tra cui Yb e Tm, sono stati preparati gli UCNP con una buona efficienza di conversione verso l’alto della regione UV (figg. S1 e S2). Gli UCNP acquosi ottenuti erano altamente cristallini e avevano morfologia esagonale, con una dimensione media delle particelle di ~ 60 nm ( Fig. 2Ae fig. S3). Rivestendo gli UCNP (positivi) con LAP (negativo) attraverso interazioni elettrostatiche, i nanoiniziatori UCNP @ LAP sono stati prontamente preparati. Dopo il rivestimento con LAP, i potenziali UC degli UCNP sono diminuiti da 53,1 ± 9,8 mV a -3,9 ± 3,56 mV (fig. S4A). Rispetto agli UCNP, le nanoparticelle UCNP @ LAP hanno mostrato una struttura a guscio evidente ( Fig. 2A ). Inoltre, il rivestimento di successo di LAP è stato verificato mediante analisi a raggi infrarossi con trasformata di Fourier (FTIR) e analisi a raggi X a dispersione di energia (figg. S4B e S5). Le corrispondenti mappature degli elementi hanno confermato le composizioni chimiche di Y e P nel nanoiniziatore ( Fig. 2B ). L’analisi termogravimetrica (TGA) ha indicato che il contenuto di LAP nel nanoiniziatore UCNP @ LAP purificato era del 12% ( Fig. 2C ). Figura 2Dmostra lo spettro di assorbimento degli spettri di emissione di luminescenza LAP (linea blu) e di conversione verso l’alto di nanoiniziatori UCNP (linea viola) e UCNP @ LAP (linea nera) in una soluzione acquosa con eccitazione di 980 nm. Gli UCNP hanno mostrato picchi di emissione di conversione a 345 e 361 nm sotto l’eccitazione della luce a 980 nm. Le bande di emissione specifiche degli UCNP avevano una buona sovrapposizione con la banda di assorbimento di LAP. Rispetto agli UCNP, le emissioni nella regione UV (da 320 a 380 nm) dei nanoiniziatori UCNP @ LAP sono scomparse, indicando che il fotone UV prodotto dagli UCNP potrebbe essere assorbito in modo efficiente dal LAP del guscio esterno ( Fig. 2D). Di conseguenza, la banda di assorbimento del cromoforo acilfosfinato di LAP a 371 nm è diminuita con l’aumento degli intervalli di tempo di luce NIR, esibendo un eccellente comportamento foto-schiarente dei nanoiniziatori (fig. S6). Dopo l’esposizione alla luce NIR per circa 15 s, la soluzione di precursore contenente il 15% in peso (% in peso) di gelMA e nanoiniziatori UCNP @ 1% in peso di LAP potrebbe essere polimerizzata in idrogel (figura S7). È stato condotto un test del rapporto di fotopolimerizzazione per valutare l’efficienza dei nanoiniziatori UCNP @ LAP in vari tempi di esposizione e potenze della luce NIR ( 26 ). Come mostrato in Fig.2 (E e F), è stato scoperto che i rapporti di fotopolimerizzazione aumentano con l’aumentare del tempo di esposizione e della potenza della luce NIR. L’acido poliacrilico (PAA) è stato utilizzato per la modifica della superficie di UCNP per evitare il rivestimento LAP. Sono stati testati i gradi del rapporto di fotopolimerizzazione di GelMA rispetto al tempo sotto la luce NIR per UCNP @ LAP, UCNP @ LAP e PAA e UCNP @ PAA e LAP. Come mostrato in fig. S8, l’efficienza del nanoiniziatore UCNP @ LAP era superiore a quella del sistema di miscelazione UCNP e LAP (fig. S8). Questi risultati indicano che le nanoparticelle UCNP @ LAP progettate possono funzionare come un iniziatore efficiente per iniziare la polimerizzazione indotta dalla NIR di monomeri di idrogel comunemente usati.

Fig. 2 Caratterizzazione dei nanoiniziatori UCNP @ LAP.
( A ) Immagini al microscopio elettronico a trasmissione di UCNP acquosi e nanoiniziatori UCNP @ LAP. I nanoiniziatori UCNP @ LAP mostrano una struttura a guscio evidente. Barre di scala, 20 (in alto) e 50 nm (in basso). ( B ) Mappatura elementale di un singolo nanoiniziatore UCNP @ LAP, che indica la distribuzione degli elementi Y e P. Barra della scala, 20 nm. ( C ) Curve di analisi termogravimetrica (TGA) di nanoiniziatori UCNP (linea nera) e UCNP @ LAP (linea rossa) delle analisi eseguite in atmosfera di N 2 . ( D ) Spettro di assorbimento degli spettri di emissione di luminescenza LAP (linea blu) e di up-conversione di UCNP (linea viola) e nanoiniziatori UCNP @ LAP (linea nera) in soluzione acquosa con eccitazione di 980 nm. au, unità arbitrarie. ( E) Grado di rapporto di fotopolimerizzazione di GelMA (15% in peso) rispetto al tempo sotto luce NIR 2-W per varie concentrazioni di nanoiniziatori UCNP @ LAP: 0,5 (nero), 1 (rosso) e 2% in peso (blu). ( F ) Grado del rapporto di fotopolimerizzazione rispetto al tempo usando UCNP @ LAP (1% in peso) come PI per varie potenze della luce NIR: 1,5 (nero), 2,5 (rosso) e 3,5 W (blu). PL, fotoluminescenza.
Potenziale del processo DNP nella bioprinting
Innanzitutto, il potenziale del processo DNP nella bioprinting è stato valutato in vitro. A causa dell’eccellente capacità di supportare le cellule per la sopravvivenza o la proliferazione, gli idrogel biocompatibili sono comunemente usati come materiali di matrice per la bioprinting. Qui, abbiamo scoperto che il processo DNP poteva stampare velocemente gli ostacoli di idrogel derivati da GelMA in modo strato per strato, e il tempo di stampa di uno strato spesso 200 micron è di circa 15 s. Quindi, è stata valutata la capacità del processo DNP nella stampa 3D di costrutti complessi di idrogel. Come mostrato in Fig. 3A, i microcostruiti a tre anelli con larghezze decrescenti da 200 a 100 μm potrebbero essere fabbricati con precisione usando questo processo DNP. Inoltre, strutture 3D complesse, come microstrutture a doppio strato con forme simili a Danboard e simili a fiori, microstruttura a tre strati con forma rotonda simile a una torta e un tipo di struttura a traliccio, possono essere prontamente fabbricate ex vivo ( Fig. 3A ). Ciò indica che il processo DNP ha una potenziale applicazione nella stampa precisa di strutture 3D personalizzate.
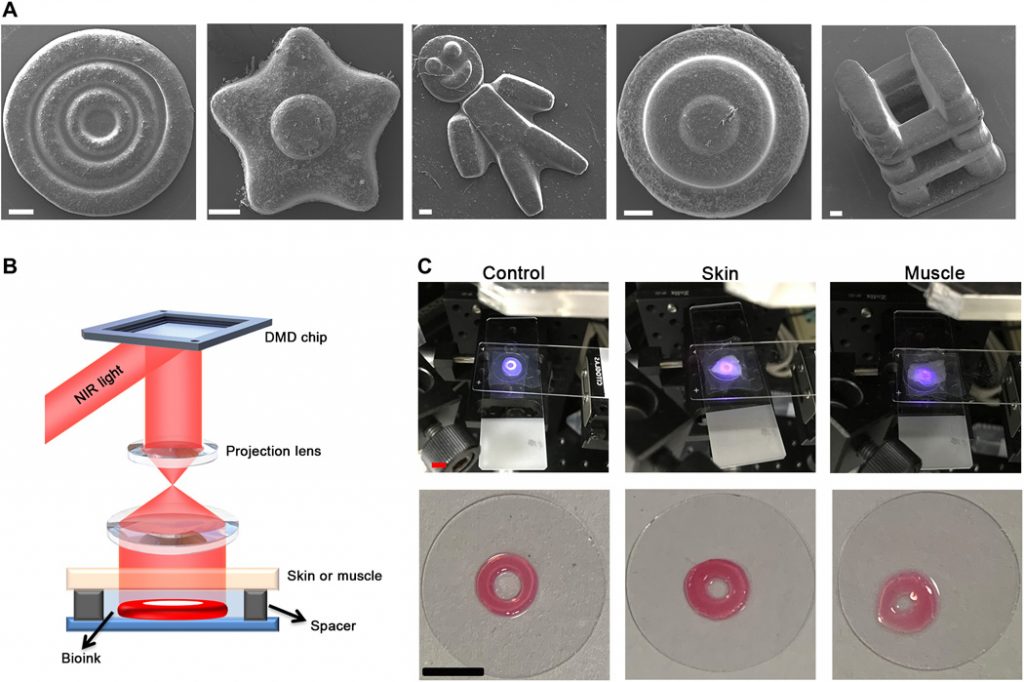
Fig. 3 Costrutti acellulari di bioprinting 3D mediante processo basato su DNP in vitro.
( A ) Immagini al microscopio elettronico a scansione (SEM) di costrutti fabbricati inclusi microcostrutti a tre anelli con larghezza decrescente, simili a fiori, simili a Danboard, a forma di torta rotonda e un tipo di costrutti di capriata. Barre di scala, 200 micron. ( B ) Diagramma schematico del setup di stampa utilizzato per stimare la capacità di penetrazione dei tessuti. Il bioink è stato depositato sotto la pelle o il muscolo. ( C ) Le immagini di costrutti di anello stampati da bioink (controllo) o bioink ricoperti da pelle o muscoli spessi 0,5 mm mediante processo DNP. Barre di scala, 0,5 cm. Credito fotografico: Yuwen Chen, State Key Laboratory of Biotherapy and Cancer Center.
Quindi, la fattibilità del processo DNP nella stampa 3D in vivo non invasiva è stata studiata usando un modello ex vivo. Come mostrato in Fig. 3B , un pezzo di pelle di topi o tessuto muscolare di maiale di 0,5 mm di spessore è stato coperto sul bioink per imitare i fenomeni del bioprinting 3D in vivo non invasivo. Come mostrato in Fig. 3C , la luce NIR con un motivo circolare potrebbe penetrare efficacemente attraverso la pelle o il muscolo, per eccitare un’emissione modellata dai nanoiniziatori UCNP @ LAP nel bioink e quindi indurre la polimerizzazione. Sotto la copertura della pelle o dei muscoli, i microcostrutti circolari potrebbero essere stampati con successo. Rispetto al gruppo di controllo, la copertura della pelle o del tessuto muscolare non ha influenzato sostanzialmente la qualità di stampa in questo esperimento ( Fig. 3C). Il software ImageJ è stato utilizzato per calcolare le aree dei costrutti stampati. L’entità del difetto del costrutto stampato dal bioink coperto dal muscolo è del 12,1%. Questi risultati indicano la potenziale applicazione del processo DNP nel bioprinting 3D in vivo non invasivo.
Inoltre, la promessa del processo DNP nella stampa 3D in vivo non invasiva è stata studiata in vivo. Dopo che 50 microlitri di una soluzione precursore sono stati iniettati per via sottocutanea nei topi BALB / c, i dati di un modello CAD sono stati inviati nel chip DMD attraverso il computer, per creare un modello NIR personalizzato per polimerizzare la soluzione monomerica in vivo. Considerando la differenza tra concentrazione di ossigeno in vitro e in vivo che può eliminare i radicali liberi per inibire la polimerizzazione ( 27 , 28), abbiamo studiato l’effetto del livello di ossigeno sulla polimerizzazione indotta da NIR. Dopo lo spurgo con azoto per degasare l’ossigeno, si è verificata la fotopolimerizzazione entro 20 s a bassa concentrazione (0,5% in peso) di UCNP @ LAP (fig. S9). Ciò indica che l’inibizione dell’ossigeno potrebbe migliorare la polimerizzazione dei radicali liberi indotta dal NIR, come potrebbe anche essere supportato da studi precedenti ( 27 , 28). Rispetto alla condizione in vitro, la condizione in vivo che spesso ha una concentrazione di ossigeno inferiore potrebbe facilitare il processo basato sul DNP per la bioprinting. La colorazione di ematossilina ed eosina (H&E) dei tessuti circondati dai costrutti di idrogel stampati in modo non invasivo è stata eseguita per determinare il potenziale effetto collaterale di questo processo DNP. I risultati mostrano che, 1 o 7 giorni dopo la stampa, i tessuti circostanti hanno strutture tissutali complete senza infiammazione significativa e difetti anomali ( Fig. 4A ). Ciò indica che il processo di bioprinting non invasivo basato su DNP non ha provocato effetti collaterali evidenti in situ. Per valutare la flessibilità del processo DNP nella bioprinting non invasiva in vivo, abbiamo progettato e stampato diverse strutture. Come mostrato in Fig. 4B, tre tipi di strutture, inclusi triangoli, croce e costrutti di idrogel a forma di torta a due strati, sono stati stampati con successo in modo non invasivo dal processo DNP in vivo. Ciò indica che il processo DNP ha il potenziale per la bioprinting 3D in vivo non invasiva.
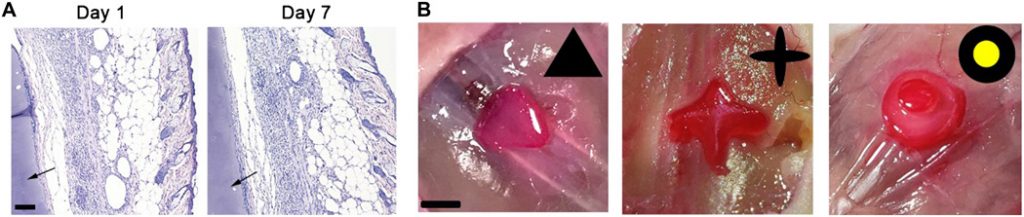
Fig. 4 Costrutti acellulari di bioprinting 3D mediante processo basato su DNP in vivo.
( A ) H&E del tessuto circostante del costrutto dopo la stampa DNP in vivo per 1 e 7 giorni. La freccia rappresenta il costrutto stampato. Barra della scala, 100 micron. ( B ) Modelli CAD e triangoli colorati a base di vitamina B12, croce e costrutti a forma di torta a due strati fabbricati mediante processo non invasivo a base di DNP in vivo. Barra della scala, 0,5 cm. Credito fotografico: Jiumeng Zhang, State Key Laboratory of Biotherapy and Cancer Center.
Bioprinting 3D in vivo non invasivo per ricostruzione o riparazione di tessuti
Il difetto del padiglione auricolare causato da malformazione congenita (microtia) o trauma è una delle malattie comuni che possono influenzare in modo critico il benessere psicologico e fisiologico dei pazienti. Il tasso di prevalenza regionale della microtia varia da 0,83 a 17,4 per 10.000 nascite in tutto il mondo, con tassi di prevalenza più alti negli asiatici ( 29 ). Il difetto del padiglione auricolare spesso richiede l’impianto del padiglione auricolare artificiale in vivo ( 29 , 30 ). Mentre il processo di impianto causerebbe lesioni iatrogene, un processo non invasivo è molto desiderato sia per i pazienti che per i medici. Qui, abbiamo effettuato un tentativo di utilizzare il processo DNP per preparare in modo non invasivo un costrutto vivente personalizzato simile all’orecchio in vivo. Come mostrato in Fig. 5C , una forma dell’orecchio personalizzata ( Fig. 5C) è stato acquisito secondo l’immagine speculare ( Fig. 5B ) dell’altro orecchio sano ( Fig. 5A ). Sotto la copertura della pelle, il costrutto a forma di orecchio contenente condrociti potrebbe essere stampato in vitro ( Fig. 5D ). Le cellule avevano una buona vitalità dopo stampa e coltura per 7 giorni in vitro (vitalità cellulare,> 80) ( Fig. 5E ). Inoltre, è stata eseguita la bioprinting 3D in vivo non invasiva basata su DNP. Il bioink contenente condrociti sono stati iniettati per via sottocutanea nei topi, seguiti dall’illuminazione con la codifica NIR digitale della forma dell’orecchio personale. Venti secondi dopo, il costrutto a forma di orecchio è stato stampato in modo non invasivo in vivo ( Fig. 5F ). Dopo 1 mese, la forma dell’orecchio del costrutto è stata mantenuta ( Fig. 5G). L’analisi istologica ha mostrato le lacune ovoidali dei condrociti con secrezione di collagene di tipo II nella matrice extracellulare ( Fig. 5, H e I ). Insieme, con la crescita dei condrociti, il tessuto simile all’orecchio si è formato in situ. Il costrutto vivente personalizzato simile all’orecchio ha una promettente applicazione nella futura rigenerazione dei tessuti e nella ricostruzione del padiglione auricolare. Questi risultati indicano che la tecnologia di bioprinting 3D in vivo non invasivo basata su DNP ha il potenziale nella preparazione di tessuti complessi in situ per la ricostruzione di organi, con lesioni iatrogene minime.
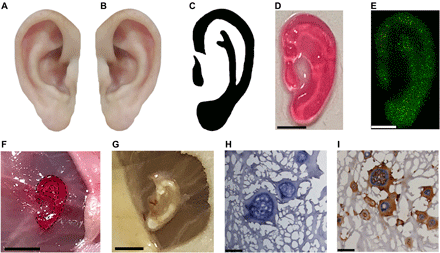
Fig. 5 Tessuto orecchio non invasivo per bioprinting 3D mediante processo basato su DNP.
( A ) Immagine rappresentativa dell’orecchio normale. ( B ) Immagine speculare di (A). ( C ) Immagine ottimizzata del profilo dell’orecchio di (B). ( D ) Immagine del costrutto simile a un orecchio stampato dal bioink coperto dalla pelle mediante processo DNP. Barra della scala, 2 mm. ( E ) La colorazione Live / Dead per costrutti auricolari incapsulati con condrociti bioprinted dal bioink coperto dalla pelle dopo coltura per 7 giorni. Barra della scala, 2 mm. ( F ) Bioprinting 3D non invasivo del costrutto a forma di orecchio in vivo mediante processo basato su DNP. Il costrutto a forma di orecchio è stato stampato per via sottocutanea in topi nudi BALB / c. Barra della scala, 5 mm. ( G ) Immagine rappresentativa del costrutto a forma di orecchio bioprinted a 1 mese. Barra della scala, 5 mm. ( H) Immunocolorazione di collagene di tipo II H&E e ( I ) del costrutto a forma di orecchio recuperato a 1 mese. Barre di scala, 50 micron. Credito fotografico: Yuwen Chen, State Key Laboratory of Biotherapy and Cancer Center.
Le lesioni chiuse con difetti dei tessuti possono essere causate da molteplici ragioni come la schiacciamento della forza contundente ( 31 ). La consegna locale di cellule staminali come le cellule staminali derivate adipose (ASC) può favorire la rigenerazione dei tessuti ( 32 , 33 ). Un’impalcatura conforme contenente ASC ha una potenziale applicazione nella riparazione del difetto del tessuto. L’installazione non invasiva dei ponteggi carichi di cellule conformi nel difetto potrebbe evitare il processo di impianto causato da lesioni iatrogene. Qui, uno scaffold carico di ASC conforme è stato stampato in modo non invasivo in situ per promuovere la guarigione del difetto muscolare in vivo. Innanzitutto, è stato costruito un modello di guarigione della ferita del muscolo escissionale nei topi BALB / c ( Fig. 6A). Quindi, per abbinare la forma della ferita, un’impalcatura carica di ASC con una forma triangolare di 8 mm è stata stampata in modo non invasivo dal processo DNP in situ. Dopo 10 giorni, il gruppo di trattamento ha mostrato un miglioramento significativo nella chiusura della ferita rispetto al gruppo di controllo ( Fig. 6, B e C ). L’analisi istologica, come mostrato in Fig. 6D, mostra che la formazione del tessuto muscolare del gruppo di trattamento era significativamente migliore di quella del gruppo di controllo. Ciò indica che l’impalcatura conforme carica di ASC potrebbe accelerare la guarigione della ferita. Nel frattempo, la colorazione H&E ha mostrato che questo trattamento non ha causato tossicità sistemica significativa in vivo (fig. S10). Pertanto, la bioprinting 3D in vivo non invasiva del ponteggio carico in situ conforme in situ ha una potenziale applicazione nella riparazione dei tessuti per il trattamento di lesioni chiuse.
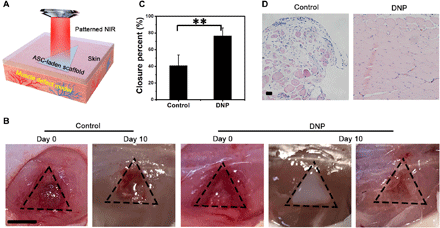
Fig. 6 Impalcatura con carico di ASC conforme alla bioprinting 3D non invasiva per la riparazione dei difetti muscolari mediante il processo basato su DNP.
( A ) Illustrazione schematica del ponteggio carico di ASC conforme per la riparazione dei difetti muscolari. ( B ) Le immagini rappresentative mostrano un’accelerazione della guarigione della ferita del gruppo DNP rispetto al controllo. Barra della scala, 5 mm. ( C ) Chiusura percentuale delle ferite muscolari valutata al giorno 10. ** P <0,01, n = 5. ( D ) Analisi istologica H&E della guarigione delle ferite muscolari al giorno 10 dopo i trattamenti. Barra della scala, 50 micron. Credito fotografico: Yuwen Chen, State Key Laboratory of Biotherapy and Cancer Center.
DISCUSSIONE
Una tecnologia dirompente è una nuova tecnologia che ha un grande effetto di promozione sulle tecnologie che esistevano prima. Le tecnologie dirompenti possono creare prodotti e servizi che diventano significativamente migliori, più economici e più convenienti. Nel frattempo, offrono anche un cambiamento rivoluzionario nella conduzione di operazioni o processi. La stampa 3D è riconosciuta come una tecnologia dirompente, emersa negli ultimi anni che potrebbe rivoluzionare le tecnologie di produzione in più campi, tra cui ingegneria di produzione, fabbricazione elettronica, materiali e tessuti artificiali. Attualmente, la mancanza di tecnologie di stampa 3D avanzate è una delle maggiori sfide per lo sviluppo di prodotti stampati in 3D. La tecnologia di stampa 3D basata su DLP offre uno strumento di bioprinting avanzato per la medicina della rigenerazione e lo sviluppo di farmaci. Recentemente,34 , 35 ). Nel frattempo, i progressi nella tecnologia della bioprinting hanno portato all’avanzamento di medicinali, come i costrutti di organi simili a polmoni stampati in 3D ( 36 ), i costrutti di organi simili a cuore ( 5 ) e le impalcature per la riparazione spinale ( 3)). Tuttavia, diverse applicazioni mediche significano sempre requisiti diversi per la tecnologia di stampa 3D. Un sistema di stampa 3D è spesso difficile da soddisfare i requisiti di diverse applicazioni mediche. Pertanto, è molto importante personalizzare i sistemi di stampa 3D per le specifiche applicazioni mediche. In questo lavoro, per soddisfare i requisiti della medicina minimamente invasiva o non invasiva, abbiamo dimostrato una bioprinting 3D in vivo non invasivo basata su DNP. Per quanto ne sappiamo, questo lavoro potrebbe essere il primo rapporto per il processo DNP e il bioprinting 3D in vivo non invasivo, che potrebbe ispirare lo sviluppo di nuove tecnologie di bioprinting 3D.
Per la fotopolimerizzazione, una fonte di luce comunemente usata è la luce UV. Tuttavia, la luce UV danneggia sempre le cellule e la sua capacità di penetrazione nei tessuti è limitata, portando alla limitazione nella bioprinting. A causa della buona biocompatibilità, la luce blu ha attirato molta attenzione nella bioprinting negli ultimi anni. Per il processo DNP, è essenziale utilizzare la luce NIR. A causa della caratteristica a bassa energia del fotone NIR e dell’inadeguato assorbimento del fotone degli iniziatori, permangono sfide per indurre in modo efficiente la polimerizzazione da parte della luce NIR. Attualmente, alcune molecole organiche come la batterioclorofilla a ( 37 ) e il colorato borato ( 38) sono stati trovati come iniziatori per la polimerizzazione indotta da NIR. Tuttavia, è difficile utilizzare questi iniziatori idrofobici direttamente nella preparazione del sistema idrofilo idrofilo. Con lo sviluppo di materiali di conversione verso l’alto come gli UCNP, il NIR può essere convertito in UV per indurre la fotopolimerizzazione, fornendo un metodo alternativo per lo sviluppo di nuove polimerizzazioni indotte dal NIR. In precedenza, sono stati fatti alcuni tentativi di utilizzare la luce NIR per indurre la polimerizzazione di una soluzione monomerica contenente UCNP e PI sensibili alla luce UV-Vis (UV-Vis), dove l’efficienza deve ancora essere migliorata ( 13 , 39). In questo studio, abbiamo progettato una nanoparticella UCNP con rivestimento LAP come nanoiniziatore per la polimerizzazione indotta dalla NIR. Il LAP può assorbire efficacemente i fotoni UV emessi dagli UCNP sotto irradiazione NIR. L’effetto dannoso delle sue emissioni UV sulle celle può essere evitato grazie a UCNP @ LAP che emette principalmente luce visibile. Nel frattempo, l’efficienza dei nanoiniziatori UCNP era superiore a quella del sistema di miscela UCNP e LAP. Ciò potrebbe essere dovuto al fatto che il rivestimento LAP su UCNP potrebbe ridurre al minimo l’effetto estinguente dell’acqua della sua luminescenza di conversione verso l’alto, derivante dall’attenuazione del contatto superficiale tra UCNP e acqua ( 40).). In questo lavoro, i nanoiniziatori UCNP @ LAP supportano solidamente la tecnologia di bioprinting 3D in vivo non invasiva migliorando l’efficienza di polimerizzazione indotta dalla NIR e la velocità di stampa. Inoltre, lo spunto di progettazione del nanoiniziatore LAP @ UCNP potrebbe ispirare lo sviluppo di iniziatori più efficienti per la polimerizzazione indotta dalla NIR.
Difetti o lesioni tissutali sono malattie comuni che spesso causano morte o disabilità. Le cellule staminali hanno grandi promesse per la ricostruzione o la riparazione dei tessuti nel trattamento di difetti o lesioni dei tessuti ( 3 , 30). Come metodo minimamente invasivo o non invasivo, l’iniezione è ben accettata per introdurre terapie nel corpo per il trattamento della malattia. Tuttavia, le cellule a iniezione diretta hanno spesso una bassa sopravvivenza e una distribuzione dei tessuti insoddisfatta in vivo. Per affrontare questo problema, abbiamo rivestito le cellule con biomateriali per migliorare la sopravvivenza e la distribuzione dei tessuti nel focus. Nel frattempo, le cellule iniettate o le microparticelle caricate da cellule sono molto difficili da formare un tessuto complesso o un organo in vivo per il trattamento di difetti complessi del tessuto come il difetto del padiglione auricolare. Convenzionalmente, i costrutti di tessuto vengono prima preparati ex vivo e quindi impiantati in situ. In questo processo, è molto difficile evitare l’intervento chirurgico che spesso causa lesioni iatrogene. Recentemente,41 , 42 ). Inoltre, alcuni materiali a memoria di forma sono stati progettati per la medicina minimamente invasiva o non invasiva ( 43). Nonostante questi progressi, è ancora difficile creare un complesso complesso di tessuti in vivo attraverso un metodo minimamente invasivo o non invasivo. Inoltre, sono spesso necessari costrutti di tessuto personalizzati per la ricostruzione o la riparazione dei tessuti. Qui, sfruttando i vantaggi della stampa 3D nella fabbricazione di strutture personalizzate o complesse, dimostriamo una nuova tecnologia di stampa 3D basata su DNP per la fabbricazione non invasiva di costrutti di tessuto personalizzati dalle cellule contenenti bioink iniettati. Usando questa tecnologia DNP, il costrutto personalizzato di tessuto a forma di orecchio è stato stampato in modo non invasivo in situ e gradualmente condondificato con il tempo, mostrando potenziale applicazione nel trattamento del difetto del padiglione auricolare o microtia. Nel frattempo, l’impalcatura conforme ASC caricata in modo non invasivo può promuovere la guarigione dei difetti muscolari, mostrando potenziale applicazione clinica. Pertanto, la tecnologia di bioprinting 3D in vivo non invasiva dimostrata potrebbe fornire un nuovo strumento per far avanzare la medicina minimamente invasiva o non invasiva, mostrando potenziali applicazioni cliniche.
In sintesi, questo lavoro contribuisce in modo solido a proporre il nuovo concetto di bioprinting 3D in vivo non invasivo, ovvero la stampa 3D non invasiva del bioink nel corpo in prodotti biomedicali personalizzati, compresi i tessuti viventi in situ. Il bioink viene introdotto localmente nel corpo con metodi minimamente invasivi o non invasivi, come l’iniezione e la perfusione. Il consolidamento spaziale del bioink è indotto da strumenti non invasivi, come il NIR digitale e il campo magnetico. Ricerche future nel campo della bioprinting 3D in vivo non invasivo faranno avanzare in modo significativo le tecnologie correlate e le applicazioni cliniche.
CONCLUSIONE
Questo lavoro dimostra un sistema di bioprinting basato su DNP, in cui i costrutti complessi possono essere fabbricati strato per strato usando la polimerizzazione NIR avviata da nanoparticelle UCNP @ LAP. Con questo sistema, i costrutti viventi personalizzati possono essere stampati in modo non invasivo in vivo dal bioink iniettato per via sottocutanea, per la ricostruzione di organi o la riparazione dei tessuti, mostrando potenziali applicazioni cliniche. Questo lavoro fornisce la prova del concetto per la bioprinting 3D in vivo non invasiva che aprirebbe una nuova strada per la stampa 3D medica e farebbe avanzare la medicina minimamente invasiva o non invasiva.
MATERIALI E METODI
YCl 3 anidro (99,9%), YbCl 3 anidro (99,9%), TmCl 3 anidro (99,9%), NaOH (> 98%), acido oleico (90%), PAA (Mn = 5100) e gelatina di tipo A e l’anidride metacrilica (MAA; 94%) è stata acquistata da Sigma-Aldrich. YCl 3 anidro (99,99%), 1-ottadecene (90%), NH 4F (> 98%) e dimetil fenilfosfonite (98%) sono stati acquistati da Alfa Aesar. Il 2,4,6-trimetilbenzoil cloruro (98%) è stato acquistato da Adamas. Tutti i prodotti chimici erano di grado analitico e venivano utilizzati come ricevuti senza ulteriore purificazione. Il topo neonato, i topi nudi BALB / c e i topi BALB / c sono stati acquistati dalla Beijing Huafukang Bioscience Co. Inc. e tenuti in una fattoria. Tutti gli studi sugli animali sono stati condotti in conformità con le linee guida sulla cura degli animali e presso il State Key Laboratory of Biotherapy, Università di Sichuan, Cina.
Sintesi di UCNP acquosi
Gli UCNP acquosi sono stati sintetizzati usando un metodo modificato ( 24 ). In una tipica sintesi di nuclei UCNP: NaYF 4 : Yb, Tm (30 / 0,3 mole percentuali), YCl 3 (108,3 mg, 0,556 mmol), YbCl 3 (67,0 mg, 0,24 mmol) e TmCl 3 (1,1 mg, 0,004 mmol) sono stati aggiunti a un matraccio da 100 ml contenente 6 ml di acido oleico e 14 ml di 1-ottadecene. Quindi, la soluzione è stata lentamente riscaldata a 140 ° C sotto vuoto per 1 ora fino a ottenere una soluzione omogenea trasparente di colore giallo chiaro. Quindi, 10 ml di soluzione di metanolo di NH 4Sono stati aggiunti F (118,4 mg, 3,2 mmol) e NaOH (80 mg, 2 mmol) e la risultante miscela torbida è stata agitata per 30 minuti a 50 ° C. Il metanolo è stato distillato. La soluzione è stata riscaldata a 300 ° C rapidamente sotto il flusso di N 2 e mantenuta per 1,5 ore. La miscela è stata fatta precipitare con l’aggiunta di 20 ml di etanolo e il precipitato è stato raccolto mediante centrifugazione a 6500 rpm per 5 minuti. Dopo quattro lavaggi, il prodotto finale NaYF 4 : Yb, Tm è stato ridisperso in 4 ml di cicloesano.
Quattro millilitri di NaYF 4 preparato in precedenza : Yb, Tm (disperso in cicloesano) sono stati fatti reagire con YCl 3 in un matraccio da 100 ml contenente acido oleico e 1-ottadecene. Le procedure successive sono state eseguite allo stesso modo della sintesi dei nuclei UCNP. Il prodotto è stato raccolto mediante centrifugazione e quindi ridisperso in soluzione di HCl 0,1 M. La miscela è stata quindi sonicata a 45 ° C per 1 ora per rimuovere i leganti di oleato. Il prodotto è stato ridisperso in acetone e le particelle sono state recuperate mediante centrifugazione. Infine, le nanoparticelle sono state disperse in acqua ad una concentrazione di 50 mg / ml.
Sintesi del PI LAP
Il 2,4,6-trimetilbenzoil cloruro è stato fatto reagire con dimetilfifosfonite attraverso una reazione di Michaelis-Arbuzov ( 25 ). La struttura del LAP è stata confermata dalla risonanza magnetica nucleare 1 H (NMR). 1 H NMR (400 MHz, D 2 O) δ da 7,79 a 7,72 (m, 2H), da 7,64 a 7,58 (m, 1H), da 7,54 a 7,49 (m, 2H), 6,93 (s, 2H), 2,28 (s, 3H) e 2,07 (s, 6H).
Preparazione di nanoiniziatori UCNP @ LAP
I nanoiniziatori sono stati preparati rivestendo UCNP (positivo) e LAP (negativo) attraverso interazioni elettrostatiche. Una soluzione di LAP (50 mg) disciolta in acqua ionizzata è stata aggiunta a gocce a una soluzione acquosa contenente 50 mg di UCNP con ultrasuoni e la miscela risultante è stata sonicata per diverse ore. Sono stati ottenuti i nanoiniziatori UCNP @ LAP purificati seguiti da centrifugazione.
Sintesi di GelMA
GelMA è stato sintetizzato, come precedentemente riportato ( 44 ). La gelatina (10 g) è stata sciolta in una soluzione acquosa di 100 ml di Na 2 CO 3 (0,63 g) e NaHCO 3 (1,47 g). MAA (1 ml) è stato aggiunto a gocce alla soluzione di gelatina sotto agitazione a 50 ° C. Dopo 3 ore, il pH è stato regolato su 7 aggiungendo HCl 6 M per fermare la reazione. GelMA è stato ottenuto dopo filtrazione, dialisi e liofilizzazione.
Caratterizzazione
Gli spettri 1 H NMR sono stati registrati usando uno spettrometro Bruker a 400 MHz. Immagini al microscopio elettronico a trasmissione sono state acquisite su un microscopio elettronico Tecnai G2 F20 S-TWIN operante a 200 kV. L’immagine al microscopio elettronico a scansione (SEM) è stata eseguita su un microscopio elettronico JSM-7500F operante a 30 kV. Gli spettri FTIR sono stati registrati su uno spettrofotometro Nicolet 6700. misurazioni della diffrazione di raggi X sono state eseguite a temperatura ambiente equipaggiate con un diffrattometro empireo usando radiazioni Cu Kα. Gli spettri UV-Vis sono stati registrati su uno spettroscopio Shimadzu UV-3101PC. Spettri di emissione di luminescenza ad alta conversione sono stati registrati su uno strumento F-7000 per spettrometro a fluorescenza dotato di un laser a semiconduttore esterno da 980 nm (Changchun Laser Optoelectronics Technology Co. Ltd.).
Test del rapporto di fotopolimerizzazione
Per valutare come il rapporto di vulcanizzazione è influenzato dalla concentrazione, dal tempo di irradiazione e dalla potenza della luce NIR, è stato condotto un test del rapporto di fotopolimerizzazione ( 26 ). Durante il tempo di irradiazione sono stati testati punti di 10, 20, 30 e 40 s, un inchiostro acquoso contenente GelMA (15% in peso) e diverse concentrazioni di nanoiniziatori UCNP @ LAP o diversa potenza NIR (980 nm). L’inchiostro acquoso è stato essiccato sotto vuoto e pesato ( W o ). L’inchiostro acquoso indurito con NIR è stato lavato con acqua distillata per 1 giorno, quindi essiccato sotto vuoto e pesato ( W t ). La resa in gel (%) è stata calcolata usando l’equazione
Grado di rapporto di fotoincisione ( % ) = Wt/W0× 100
Costrutti acellulari in vitro
La stampante DNP era principalmente costituita da un chip DMD (Discovery 4100, Texas Instruments, USA) con una risoluzione di 1024 × 768 e una sorgente di luce NIR da 980 nm (Changchun Laser Optoelectronics Technology Co., Cina). I modelli costruttivi sono stati stabiliti e quindi suddivisi in immagini utilizzando il software Creation Workshop. Queste immagini sono state inviate nel chip DMD utilizzando il software GUI di Discovery 4100. Dopo aver aggiunto il bioink (nanoiniziatori 15% in peso GelMA e 1% in peso UCNP @ LAP) alla piattaforma di stampa, la piattaforma è stata spostata e fissata nella posizione designata. Uno strato di 200 micron di spessore è stato stampato dall’esposizione della luce NIR modellata eccitata da DMD per 15 s. Per la fabbricazione di una struttura multistrato, dopo che il primo strato è stato stampato completamente, la piattaforma è stata spostata verso il basso di 200 micron. Lo stesso volume del bioink è stato aggiunto ed esposto dalla luce NIR con il modello del secondo strato. Ripetendo questa procedura, è possibile fabbricare un costrutto multistrato.
Per imitare i fenomeni del bioprinting 3D in vivo non invasivo, un pezzo di pelle di topi nudi o tessuto muscolare di maiale di 0,5 mm di spessore è stato coperto su 40 microlitri di bioink, contenente il 15% in peso di GelMA e l’1% in peso di nanoiniziatori UCNP @ LAP, e poi stampato in costrutti circolari. Il tempo di esposizione per la stampa dei costrutti del cerchio dal bioink coperto dalla pelle o dal tessuto muscolare del maiale è di circa 20 e 40 s, rispettivamente. Per quantificare l’entità del difetto del costrutto stampato dal bioink coperto dai muscoli, è stato utilizzato il software ImageJ per calcolare le aree dei costrutti stampati. La A con : l’area del cerchio costrutto che stampato da bioink senza alcuna copertura del tessuto. Un mindica l’area del costrutto del cerchio stampata dal bioink coperto dal muscolo. L’entità del difetto ( ED m ) può essere contata dalla seguente equazione: ( A con – A m ) / A con × 100%.
Coltura cellulare
I condrociti articolari ( 45 ) e le ASC ( 32 ) sono stati isolati rispettivamente da topi neonati di ratto e BALB / c di 8 settimane. Le cellule sono state coltivate in un terreno di crescita regolare Il terreno di Eagle modificato di Dulbecco, un mezzo a basso contenuto di glucosio integrato con siero bovino fetale al 10% a 37 ° C in un incubatore umidificato e al 5% di CO 2 . Le cellule sono state regolarmente raccolte mediante trattamento con una soluzione EDTA (0,25%).
Test di vitalità cellulare
Costrutti orecchio-figura sono state stampate con la bioink, contenente 15% in peso Gelma, 1% in peso nanoinitiators UCNP @ LAP, e 1 × 10 6 ml -1 cellule condrociti. La citocompatibilità è stata testata nel tempo come indicato colorando i campioni contenenti cellule usando un kit di colorazione vivo / morto (Jiangsu KeyGEN BioTECH Corp.) secondo il protocollo del produttore. I costrutti di tessuto sono stati colorati con 2 μM di calceina (colorazione di cellule vive) e 8 μM di soluzione di ioduro di propidio (colorazione di cellule morte) a temperatura ambiente per 30 minuti. Dopo l’incubazione, i campioni sono stati lavati tre volte con soluzione salina tamponata con fosfato (PBS). Le immagini di fluorescenza dei campioni sono state immediatamente registrate usando un microscopio Leica DMI6000B.
Bioprinting in vivo di costrutti acellulari
Topi BALB / c di otto settimane sono stati narcotizzati, seguiti dalla rimozione dei peli. Sterile N 2gas è stato iniettato per via sottocutanea nei topi per isolare la pelle e il tessuto muscolare per creare una cavità. Cinquanta microlitri del bioink (nanoiniziatori 15% in peso GelMA e 1% in peso UCNP @ LAP in PBS) sono stati iniettati per via sottocutanea nella cavità usando una microsiringa. Quindi, i topi sono stati fissati nel sito designato di una stampante in anestesia. Il sito di iniezione è stato irradiato dalla luce modellata NIR eccitata dal chip DMD controllato mediante un computer per 20 secondi. Per la fabbricazione di un costrutto a due strati in vivo, in primo luogo, 50 microlitri della soluzione precursore sono stati iniettati nella cavità e irradiati dalla luce NIR modellata per stampare il primo strato del costrutto. Quindi, altri 50 ml di soluzione precursore sono stati iniettati nel sito irradiato e il secondo strato è stato stampato. I topi furono sacrificati,
Colorazione immunoistochimica per H&E
I tessuti raccolti sono stati fissati con una soluzione tampone di fosfato di paraformaldeide (PFA) al 4% durante la notte a temperatura ambiente. I campioni sono stati lavati in acqua corrente, disidratati in alcool etilico classificato e lavati in xilene. I tessuti sono stati sigillati in paraffina, tagliati in fette spesse 4 micron usando un microtomo e colorati con H&E. I campioni sono stati quindi sottoposti a imaging con un microscopio Leica DMI6000B.
Fabbricazione in vivo di un edificio vivente a forma di orecchio
Topi nudi BALB / c di otto settimane erano narcotizzati. Gas sterile N 2 è stato iniettato per via sottocutanea nella parte posteriore sinistra dei topi per isolare la pelle e i tessuti muscolari per creare una cavità. Cinquanta microlitri di 1 × 10 7 cellule ml −1bioink contenente condrociti è stato iniettato nella cavità attraverso una microsiringa. Quindi, i topi sono stati fissati nel sito designato della stampante. Il sito iniettato è stato irradiato usando la luce NIR a forma di orecchio eccitata dal chip DMD per 20 s. La soluzione salina normale (NS) è stata iniettata nella parte posteriore dei topi vicino al sito di irradiazione e aspirata per rimuovere il bioink non indurito. Dopo 1 mese, i campioni sono stati raccolti e sottoposti ad analisi istologiche e immunoistochimiche. I costrutti di tessuto sono stati fissati con PFA al 4% per 30 minuti e quindi disidratati in soluzione di saccarosio al 30% a 4 ° C durante la notte. I campioni disidratati sono stati incorporati nel composto della temperatura di taglio ottimale e congelati a -80 ° C durante la notte. I campioni congelati sono stati quindi sezionati. Le sezioni sono state quindi colorate con H&E per analisi della struttura istologica.
Modello di guarigione delle ferite muscolari interne escissionale
Topi BALB / c di otto settimane sono stati narcotizzati, seguiti dalla rimozione dei peli. Sono stati eseguiti interventi chirurgici per aprire la pelle al dorso dei topi. Una ferita muscolare del triangolo di circa 8 mm è stata asportata usando un bisturi e forbici da dissezione seguite da sutura cutanea. Quindi, il contorno della ferita è stato disegnato in situ sulla pelle usando un pennarello. Dopo 24 ore, 100 ml di 1 × 10 7 cellule ml −1Il bioink contenente ASC è stato iniettato per via sottocutanea nella ferita muscolare. Quindi, i topi sono stati fissati nel sito designato della stampante in anestesia. Il sito di iniezione è stato irradiato dalla luce triangolare modellata NIR eccitata dal chip DMD per 20 s. NS è stato iniettato nella parte posteriore dei topi vicino al sito di irradiazione e aspirato per rimuovere il bioink non indurito. Tutti i topi sono stati eutanizzati dopo 10 giorni, sono state scattate foto digitali e l’area della ferita è stata misurata utilizzando il software ImageJ. Le ferite dei topi sono state utilizzate per l’analisi istologica. Per dimostrare se questo trattamento potrebbe causare una significativa tossicità sistemica in vivo, i principali organi, tra cui cuore, polmone, fegato, milza e reni, sono stati sottoposti a studio istopatologico mediante colorazione H&E.
analisi statistica
Il test t di Student è stato condotto per esaminare la differenza tra due gruppi sperimentali come i gruppi di trattamento e di controllo. Tutti i dati di questo studio sono espressi come valori medi ± DS. P <0,05 è stato considerato statisticamente significativo.