Continuando a promuovere i progressi tra la stampa 3D e l’elettronica nel campo medico, gli autori Robert Herbert, Saswat Mishra, Hyo-Ryoung Lim, Hyoungsuk Yoo e Woon-Hong Yeo esplorano un nuovo metodo per creare elettronica wireless estensibile per monitorare il flusso sanguigno verso monitorare e quindi prevenire gli aneurismi cerebrali.
Dettagli del loro studio sono delineate nella recente pubblicazione ‘ completamente stampata, senza fili, Stretchable impiantabile Biosystem verso senza batteria, monitoraggio in tempo reale di Cerebral Aneurysm Emodinamica ,’ spiega come il loro romanzo, sistema di fabbricazione ottimizzato consente la stampa a più strati di un sensore di flusso di capacità che può essere dispiegato da un catetere e quindi inserito in un vaso sanguigno.
Gli scienziati sottolineano che le tecniche di microfabbricazione hanno permesso di compiere passi da gigante nella creazione di elettronica miniaturizzata, insieme a:
Materiali morbidi
Dispositivi estensibili
biosensori
Fattori di forma bassi
Gli impianti elettronici, tuttavia, molti sono ancora inferiori in termini di distanze di interrogazione. Gli autori prevedono che i futuri dispositivi saranno estensibili e wireless, senza i componenti rigidi che vediamo ancora oggi.
“Questi componenti rigidi sono incompatibili con l’impianto nei tessuti molli o nei vasi sanguigni a causa di disallineamenti meccanici e imballaggi voluminosi”, affermano i ricercatori.
Il monitoraggio wireless dipenderà da ulteriori progressi con l’integrazione di componenti altamente conduttivi. Per la prevenzione degli aneurismi cerebrali, l’inserimento di impianti è stato storicamente difficile a causa delle arterie strette; tuttavia, il monitoraggio è fondamentale a causa del potenziale di incidenti mortali alla rottura degli aneurismi.
La stampa a getto di aerosol è stata utilizzata per risolvere le sfide tradizionali, sfruttando i vantaggi della stampa 3D: dalla produzione veloce e manifatturiera scalabile, alla facilità di progettazione e un migliore controllo; tuttavia, prima di questo studio, AJP non è stato utilizzato nella creazione di tale elettronica. I ricercatori affermano che in questo studio offrono la primissima dimostrazione di un sistema capacitivo altamente estensibile abilitato per AJP:
“La struttura a profilo estremamente basso ed estensibile consente al dispositivo di essere integrato in modo conforme su uno stent medico e distribuito tramite procedure catetere convenzionali”, hanno affermato gli autori. “L’utilizzo di un nuovo metodo di accoppiamento induttivo per monitorare l’emodinamica consente un rilevamento senza batteria e senza fili dei sensori stampati a distanze che superano i dispositivi esistenti.”
Durante la loro ricerca, gli autori hanno completato una serie di calcoli computazionali per ottimizzare i parametri, mentre studi in vitro hanno offerto dati relativi alle prestazioni delle bobine del sensore nel rilevamento wireless. Il team ha utilizzato una pompa del sangue pulsatile per testare il flusso sanguigno, con i sensori e i dispositivi di stent allineati in apertura per consentire punti di entrata e uscita attraverso un aneurisma. Alla fine, i risultati hanno mostrato “fattibilità” per la creazione di “elettronica estensibile ad alte prestazioni” tramite AJP.
“Nel complesso, questo risultato concorda perfettamente con il lavoro precedente che ha correlato la deflessione del sensore alla variazione di capacità con un modello di fluido computazionale. Il fattore di forma ultrasottile a basso profilo del sensore evita l’interruzione della normale emodinamica “, hanno affermato i ricercatori.
“Per il monitoraggio wireless, una bobina di rame è collegata esternamente al sensore capacitivo. La velocità media del flusso nel vaso sanguigno di 5 mm di diametro varia da 0 a 0,35 ms −1 a intervalli di 0,05 ms −1 . La capacità iniziale del sensore è di 61,53 pF e aumenta a 61,63 pF alla massima velocità di flusso. Questo aumento della capacità è il risultato del flusso che entra nella sacca dell’aneurisma e flette il sensore. “
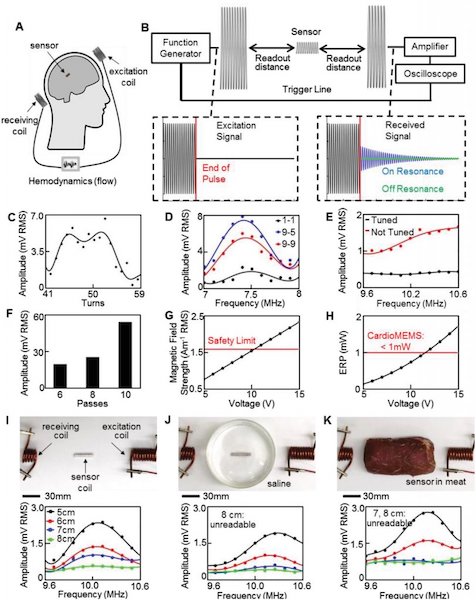
Studio parametrico e ottimizzazione di un metodo di accoppiamento induttivo. A) Panoramica schematica del sistema wireless senza batteria con un sensore di flusso impiantabile e due bobine di antenna esterne. B) Panoramica dell’apparecchiatura e esempi di segnali di eccitazione. I segnali del sensore transitorio ricevuti differiscono per i casi di risonanza on e off. C) Convalida sperimentale del numero ottimale di giri della bobina del sensore per aumentare l’ampiezza alla risonanza. D) Ampiezza del segnale in base alla frequenza che mostra la risonanza maggiore con una bobina di eccitazione a 9 giri e una bobina di ricezione a 5 giri (curva blu). E) Rumore ridotto al minimo grazie all’accordatura delle bobine dell’antenna nella gamma di frequenza di interesse. F) Ampiezza del segnale che mostra che i sensori con Ag più spessa (passaggi multipli) trasmettono un picco di risonanza maggiore. G) Confronto dell’intensità del campo magnetico di eccitazione a 1 cm di distanza dalla bobina di eccitazione e mediata su un’area proiettata di 20 × 20 cm2 con limite di sicurezza di 1,6 A m − 1. H) Il sistema CardioMEMS HF funziona con un ERP maggiore di quello utilizzato in questo lavoro con 5 V. I) Test in vitro della bobina del sensore e del condensatore ceramico in diverse condizioni, compresi gli sweep di frequenza della bobina del sensore attraverso l’aria, leggibile fino a 8 cm , J) bobina del sensore leggibile fino a 7 cm quando collocata in soluzione salina, e K) bobina del sensore con intervallo di rilevamento fino a 6 cm nella carne. 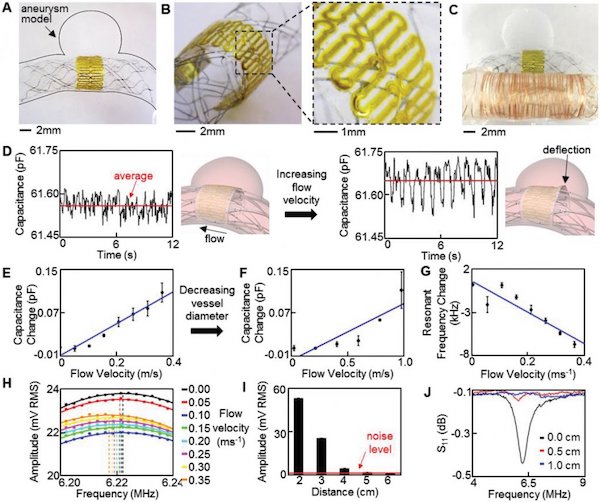
Studio in vitro delle prestazioni del sensore stampato in un modello di vaso sanguigno biomimetico. A – C) Foto di un sensore integrato nello stent medico in un modello di aneurisma, che mostra A) una panoramica ingrandita del sensore, B) inclinata, ingrandita in vista dell’ultrasottile, sensore di basso profilo e C) a sensore collegato a bobina di rame per il monitoraggio wireless dell’emodinamica nel modello biomimetico. D) Velocità del flusso pulsatile catturata dal sensore; la capacità media del sensore aumenta con velocità di flusso da 0,05 (sinistra) a 0,35 ms − 1 (destra). L’illustrazione (a destra) indica il meccanismo del cambiamento di capacità dovuto all’aumento del flusso nell’aneurisma. E, F) Variazione media della capacità con l’aumentare della velocità del flusso E) nella nave da 5 mm e F) velocità del flusso più elevata nella nave da 3,5 mm. G) Riduzione della frequenza di risonanza con aumento della velocità del flusso. H) sweep di frequenza continui, mostrando lo spostamento nella frequenza di risonanza. I) Diminuzione dell’ampiezza del picco alla risonanza con l’aumentare della distanza; La distanza di interrogazione di 6 cm viene raggiunta prima che un picco di risonanza non sia osservabile. J) Distanza di lettura ridotta (inferiore a 1 cm) nel monitoraggio della frequenza di risonanza con un VNA, che indica la superiorità del metodo di accoppiamento induttivo wireless ottimizzato. 
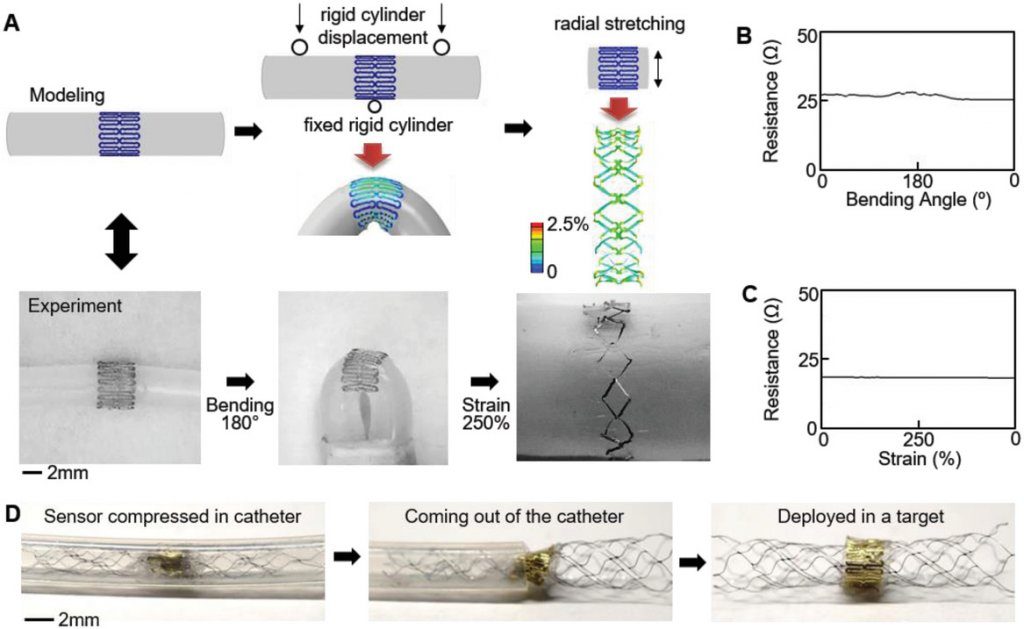
Modellazione meccanica, fabbricazione e affidabilità di un biosensore stampato per un dispiegamento basato su catetere in una nave bersaglio. A) Progettazione di un sensore altamente estensibile tramite modellazione ad elementi finiti e confronto con il sensore fabbricato. B, C) Resistenza elettrica misurata del sensore stampato in flessione ciclica e stiramento radiale, mostrando un cambiamento trascurabile della resistenza in entrambe le condizioni di carico. D) Spiegamento basato su catetere del sensore fabbricato in un vaso sanguigno bersaglio, reso possibile dalla struttura altamente flessibile ed estensibile. 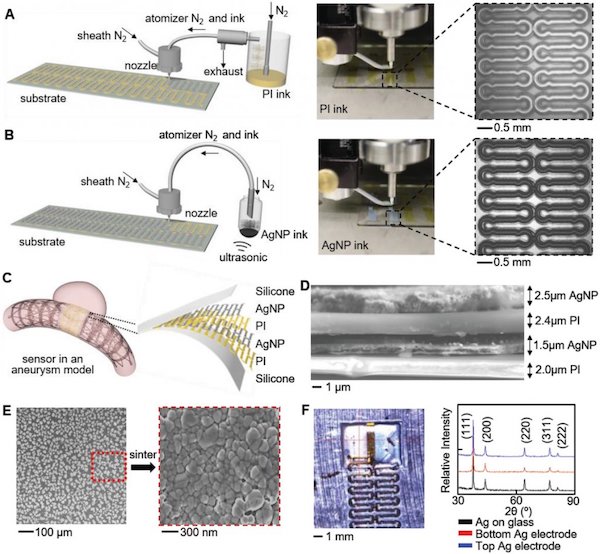
Fabbricazione AJP e caratterizzazione del materiale. A) Illustrazione e immagine della deposizione di AJP di PI usando un atomizzatore pneumatico (a sinistra). La vista ingrandita mostra una traccia PI stampata (a destra). B) Panoramica della deposizione di Ag con un atomizzatore a ultrasuoni (a sinistra) e vista ingrandita di una Ag modellata su PI (a destra). C) Illustrazione della fabbricazione abilitata per AJP di un sensore di flusso impiantabile in un modello di aneurisma. L’inserto mostra la struttura multistrato del pacchetto di sensori. D) Immagine SEM in sezione trasversale che mostra la struttura del sensore multistrato. E) Immagini SEM di AgNP stampate (a sinistra) e dopo un processo di sinterizzazione, che mostrano i cluster (a destra). F) Caratterizzazione del diffrattometro a raggi X di un AgNPs sinterizzato su vetrino, elettrodo Ag inferiore su PI ed elettrodo Ag superiore su PI. Non si osserva alcun cambiamento nella struttura cristallina per i tre casi.