Nel recente articolo ” Combinare la produzione additiva con la microfluidica: un metodo emergente per lo sviluppo di nuovi organi su chip “, i ricercatori cinesi stanno esplorando un argomento complesso ma sempre più popolare nella stampa 3D, combinando la tecnologia con dispositivi come organi su chip ( OOCs).
Mentre la produzione additiva continua a stimolare nuovi sviluppi nella ricerca e in altri settori come l’istruzione (in quasi tutti i gradi – fino ai massimi livelli di laurea) e ingegneria, continua una maggiore innovazione nei COA, piattaforme microfluidiche utilizzate per imitare la funzionalità di organi umani.
Mentre le OOC erano inizialmente molto più rudimentali e prive della necessaria regolabilità, oggi sono incredibilmente avanzate mentre gli scienziati si avvicinano sempre più al loro obiettivo di riuscire a trapiantare organi stampati in 3D nel corpo umano con successo. E mentre la bioprinting è progredita immensamente, la tecnica è ancora carica di sfide a causa della natura delicata dell’ingegneria dei tessuti.
Recentemente, sono stati fatti nuovi sforzi per la bioprint con OOC, inclusi progetti come:
Microfluidica su larga scala
Architetture cellulari 3D precise
Controllo del flusso per una manutenzione stabile del microambiente
Generazione di strutture a livello di tessuto / organo
Interfacce tessuto-tessuto
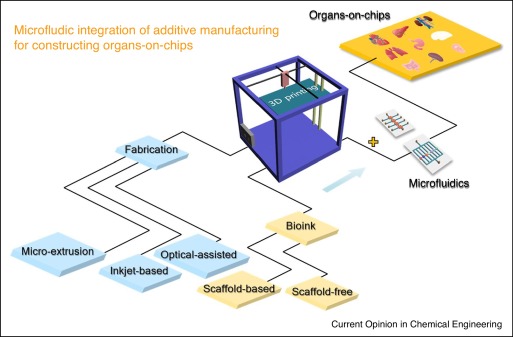
Concetto di integrazione di AM con microfluidica per OOC.
Il bioprinting è solitamente separato in metodi basati su impalcature e senza impalcature. I bioink a base di impalcatura hanno lo scopo di:
Interagisci con le cellule
Fornire veicoli per il caricamento delle celle
Costruisci impalcature per la formazione dei tessuti
Spesso vengono estratti naturalmente da materiali come gelatina o alginato, nonché sintetici come polietilenglicole e Pluronic ©.
“Negli idrogel carichi di cellule, i componenti biologicamente attivi inclusi i fattori di crescita, altre proteine associate alla matrice extracellulare (ECM) sono generalmente incapsulati per migliorare l’adesione cellulare, la proliferazione cellulare o la differenziazione”, affermano i ricercatori. “La solidificazione degli idrogel stampati è realizzata attraverso processi di reticolazione termica, foto-reticolata o ionica / chimica. Di recente, i bioink di idrogel sono stati drogati con nanomateriali per migliorare la robustezza e la differenziazione cellulare. “
Mentre la bioprinting continua ad avanzare, abbiamo visto:
Fegato-on-a-chip
Bioprinted-cuore-on-a-chip
Vascolare-on-a-chip
La caratterizzazione continua anche nelle OOC bioprintate 3D, valutando sia lo sviluppo che la funzionalità utilizzando analisi biochimiche e biomeccaniche. Come sottolineato dal team di ricerca, la vitalità cellulare è un “parametro essenziale” quando si tratta di sviluppo OOC. Studi biochimici sono usati per testare OOC anche con informazioni sull’espressione genetica e proteica.
“In breve, dal punto di vista della risoluzione di stampa, la stampa basata sull’estrusione, che è stata la più ampiamente accettata, non è ancora compatibile con tutti i progetti quando le strutture su chip diventano più sofisticate ed eterogenee. Lo SLA ha una risoluzione più elevata, ma la vitalità cellulare è inevitabilmente influenzata durante l’esposizione alla luce laser o UV ”, concludono i ricercatori.
“In parallelo, l’integrazione di sensori fisici, biochimici e ottici incorporati con OOC può registrare il comportamento delle cellule in tempo reale e i parametri ambientali. Tutte queste innovazioni estenderanno le applicazioni delle OOC integrate nella bioprinting nella ricerca fondamentale e nei contesti clinici. “
La tecnologia organ-on-a-chip continua a progredire nei laboratori di tutto il mondo, dai metodi di ingegneria avanzati ai prototipi per contribuire a ridurre i costi e persino l’uso di tali metodi per combattere le minacce virali .
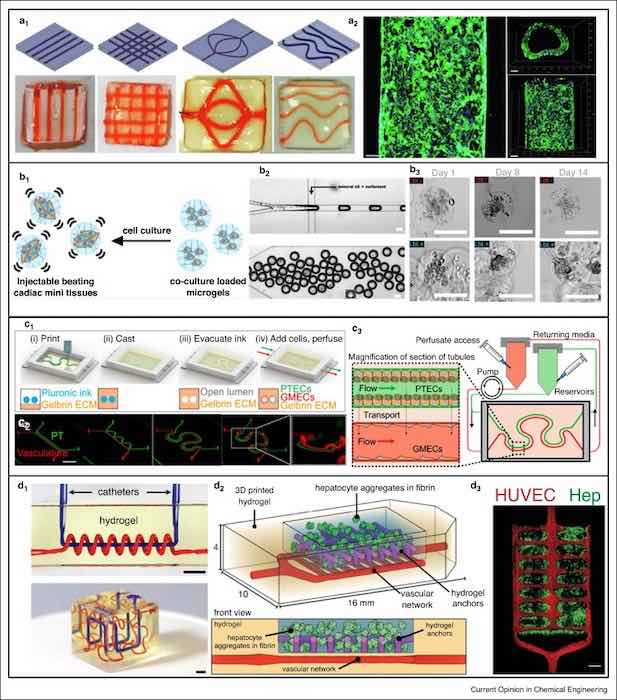
Bioprinting 3D integrato con OOC microfluidici. Fegato su chip [33]. (a1) Disegni digitali e dispositivi corrispondenti (a2) Immagini fluorescenti degli hUVEC coltivate all’interno dei canali (verde che mostra F-actina e blu che mostra i nuclei). Barra della scala: 100 micron. Heart-on-a-chip [36]. (b1) Principio del microtissuto funzionalizzato su chip mediante cocoltura di hiPSC-CM e normali fibroblasti cardiaci umani. (b2) Chip microfluidico per la generazione di goccioline cariche di cellule (sopra) seguito da trasformazione in microgel (sotto). Barra della scala: 100 micron. (b3) Micrografie di hiPSC-CM / NHCF-V in coltura ai giorni 1, 8 e 14. Rene su chip [39]. (c1) Schema del processo di fabbricazione del tubulo prossimale vascolarizzato 3D. (c2) Tubulo prossimale vascolarizzato su chip integrato. Barra della scala: 10 mm. (c3) Integrazione del tessuto tubulare prossimale vascolarizzato 3D con una perfusione ad anello chiuso per misurare il riassorbimento renale. Vascolarizzazione su chip [42 ••]. (d1) Adattamenti di curve matematiche di riempimento dello spazio a topologie di vasi aggrovigliati di nave assiale ed elica (su) e interpenetranti curve di Hilbert (giù) all’interno di idrogel. Barra della scala: 3 mm. (d2) Trasportatori di idrogel epatici creati seminando cellule endoteliali (HUVEC) nella rete vascolare dopo la stampa. (d3) Immagini al microscopio confocale di aggregati di epatociti (Hep) nel gel di fibrina intrappolati da ancore di idrogel. Barra della scala: 1 mm. Riprodotto con le autorizzazioni di Elsevier [33], American Chemical Society [36], National Academy of Sciences degli Stati Uniti d’America [39] e American Association for the Advancement of Science [42 ••]. (d1) Adattamenti di curve matematiche di riempimento dello spazio a topologie di vasi aggrovigliati di nave assiale ed elica (su) e interpenetranti curve di Hilbert (giù) all’interno di idrogel. Barra della scala: 3 mm. (d2) Trasportatori di idrogel epatici creati seminando cellule endoteliali (HUVEC) nella rete vascolare dopo la stampa. (d3) Immagini al microscopio confocale di aggregati di epatociti (Hep) nel gel di fibrina intrappolati da ancore di idrogel. Barra della scala: 1 mm. Riprodotto con le autorizzazioni di Elsevier [33], American Chemical Society [36], National Academy of Sciences degli Stati Uniti d’America [39] e American Association for the Advancement of Science [42 ••]. (d1) Adattamenti di curve matematiche di riempimento dello spazio a topologie di vasi aggrovigliati di nave assiale ed elica (su) e interpenetranti curve di Hilbert (giù) all’interno di idrogel. Barra della scala: 3 mm. (d2) Trasportatori di idrogel epatici creati seminando cellule endoteliali (HUVEC) nella rete vascolare dopo la stampa. (d3) Immagini al microscopio confocale di aggregati di epatociti (Hep) nel gel di fibrina intrappolati da ancore di idrogel. Barra della scala: 1 mm. Riprodotto con le autorizzazioni di Elsevier [33], American Chemical Society [36], National Academy of Sciences degli Stati Uniti d’America [39] e American Association for the Advancement of Science [42 ••]. (d2) Trasportatori di idrogel epatici creati seminando cellule endoteliali (HUVEC) nella rete vascolare dopo la stampa. (d3) Immagini al microscopio confocale di aggregati di epatociti (Hep) nel gel di fibrina intrappolati da ancore di idrogel. Barra della scala: 1 mm. Riprodotto con le autorizzazioni di Elsevier [33], American Chemical Society [36], National Academy of Sciences degli Stati Uniti d’America [39] e American Association for the Advancement of Science [42 ••]. (d2) Trasportatori di idrogel epatici creati seminando cellule endoteliali (HUVEC) nella rete vascolare dopo la stampa. (d3) Immagini al microscopio confocale di aggregati di epatociti (Hep) nel gel di fibrina intrappolati da ancore di idrogel. Barra della scala: 1 mm. Riprodotto con le autorizzazioni di Elsevier [33], American Chemical Society [36], National Academy of Sciences degli Stati Uniti d’America [39] e American Association for the Advancement of Science [42 ••]. 

Schemi dei metodi di stampa con celle 3D con diversi principi di funzionamento: (a1) microestrusione, (a2) a base di getto d’inchiostro e (a3) stampa laser assistita. Stampa basata su microestrusione [12]. (b1) Rendering dell’estrusore della pompa della siringa assemblato e di una stampante. (b2) Sequenza time-lapse della bioprinting 3D di un logo universitario. (b3) Cuore di collagene stampato e vista in sezione trasversale del cuore di collagene. Stampa a getto d’inchiostro [16]. (c1) Rappresentazione schematica della scacchiera 3D composta da due motivi. Modelli di un logo universitario (c2), cerchi concentrici, motivo a cerchi parziali e ‘Faccina’ (c3) ottenuti stampando inchiostro Fluo (verde) e inchiostro Acri (blu) contenente fibroblasti Tomato NIH 3T3 (rosso). (ge h: barra della scala 200 micron). (c4) Un chip microfuidico a base di idrogel bioprinting. Barra della scala: 1 mm. Stampa laser assistita [17]. (d1) Schema della scrittura diretta laser. (d2) Microsfere fabbricate e celle cariche. Barra della scala: 200 micron. (d3) Immagini al microscopio confocale di aggregato 3D MDA-MB-231. Barra della scala: 100 micron. Riprodotto con i permessi dell’American Association for the Advancement of Science [12] e Elsevier [17].