Ricercatori del Regno Unito: risoluzione a goccia singola per tessuti sintetici funzionali stampati in 3D
I ricercatori del Regno Unito hanno completato uno studio unico sulle reti stampate in 3D, rilasciando le loro scoperte nel recente pubblicato ” Imballaggio controllato e risoluzione di goccioline singole di tessuti sintetici funzionali stampati in 3D “.
Lo sviluppo di tessuti sintetici richiede precisione nelle strutture fabbricate. Attualmente, mentre ci sono sfide nella stampa 3D di tali reti, l’assemblaggio di tali geometrie può essere efficace per l’esecuzione di compiti specifici. Di fronte agli ostacoli che spesso impediscono progetti complessi e funzionalità necessarie, il team di ricerca ha studiato come bilanciare le disposizioni delle goccioline riunite con i doppi strati di interfaccia.
Ispirato ai poliedri 3D della natura, il team di ricerca ha esaminato le proprietà e le prestazioni risultanti da molecole impaccate in strutture cristalline, nonché array di cellule presenti nei tessuti. Il loro studio includeva persino la struttura dei favi. Un tale slancio nella ricerca non è nuovo in quanto gli studi sono stati accelerati da influenze come la madreperla (trovata nelle conchiglie), materiali naturali come i pigne e persino i mammiferi come i pipistrelli .
In questo studio, i ricercatori hanno sperimentato concetti di fabbricazione confinanti con il livello di stampa 4D mentre consideravano come migliorare il controllo sulle “sfere” deformabili, consentendo loro di imitare i tessuti vivi.
“In quest’area, le reti di goccioline delle dimensioni di un picolitre separate da doppi strati di interfaccia (DIB) promettono in modo significativo a causa della compartimentalizzazione discreta, della connettività intrinseca e della comunicazione tra subunità”, hanno affermato i ricercatori.
Rafforzati dalla presenza di lipidi, i DIB sono costruiti mentre le goccioline acquose si collegano nell’olio e creano un doppio strato, con reti create attraverso microfluidica, manipolazione meccanica, magnetismo e pinzette ottiche.
“Quando le goccioline acquose si impacchettano in 3D, ognuna stabilisce più contatti gocciolina-gocciolina (formando DIB con i suoi vicini), risultando nella deformazione delle goccioline sferiche in poliedrici”, hanno affermato i ricercatori.
La scienza della costruzione di tali reti richiede una comprensione approfondita di come i parametri di stampa influenzano la deformazione delle goccioline:
“Attualmente, ad esempio, il verificarsi di difetti di stampa impone che i percorsi di segnalazione conduttiva in reti di grandi dimensioni (> 100 goccioline) debbano essere progettati per essere larghi più di 2-3 gocce per garantire la continuità”, hanno affermato i ricercatori. “Tuttavia, percorsi di segnalazione a livello di singola goccia sarebbero fattibili se i tessuti sintetici potessero essere modellati alla risoluzione di una singola goccia.”
In precedenza, i ricercatori hanno esplorato la deformazione delle goccioline nelle miscele di olio e acqua, compresa la fabbricazione di sistemi microfluidici per sperimentare le gocce in fogli 2D, oltre a studiare i cluster che si auto-organizzano durante il flusso. Noto come più utile per la propria ricerca, studi di Princen et al. focalizzato sul valore degli angoli di contatto tra l’imballaggio delle goccioline sia in 2D che in 3D. In questo studio, i ricercatori hanno sperimentato reticoli esagonali ravvicinati (hcp) da centinaia di goccioline di dimensioni tricolore stampate in 3D, nonché utilizzando l’automazione per fabbricare tessuti sintetici con singole goccioline.
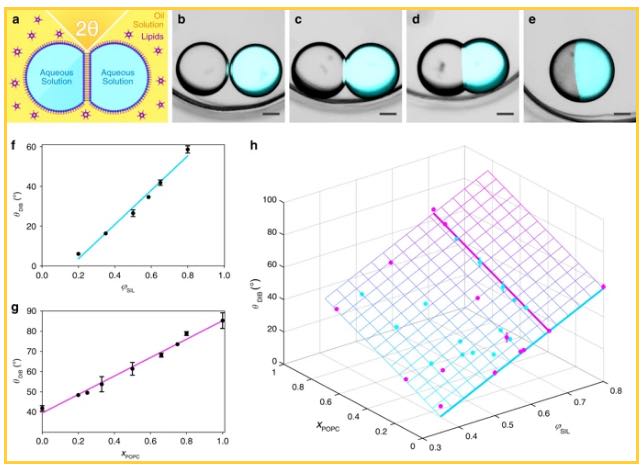
uno schema di una coppia di goccioline acquose che formano un doppio strato di interfaccia di goccioline (DIB) in una soluzione lipidica in olio e la definizione dell’angolo di contatto di equilibrio (θDIB). b – e Sovrapposizioni di microscopia a campo chiaro e fluorescenza di coppie di goccioline formate con 1 mM DPhPC e valori φSIL di 0,20 (θDIB = 6,0 ± 0,7 °) (b), 0,50 (θDIB = 26,5 ± 1,7 °) (c), 0,80 ( θDIB = 53,4 ± 0,8 °) (d) e con 1 mM POPC e φSIL = 0,65 (θDIB = 85,3 ± 3,8 °) (e). Barre di scala = 150 µm. In ogni immagine, la gocciolina destra contiene 10 µM Atto488 per dimostrare che si è formato un doppio strato e compartimenta il colorante doppio strato-impermeant. f Un diagramma che mostra la dipendenza lineare di IBDIB rispetto a φSIL per 1 mM DPhPC (regressione lineare R2 = 0,99) (vedere la tabella supplementare 1). g Un grafico che mostra la dipendenza lineare di IBDIB rispetto a xPOPC a φSIL = 0,65 (regressione lineare R2 = 0. 99) (vedi tabella supplementare 2). h Un diagramma della dipendenza lineare 2D di IBDIB rispetto sia a φSIL che a xPOPC (piano di regressione R2 = 0,99) (vedere la Tabella complementare 8). La concentrazione lipidica totale era di 1 mM. I punti dati che si trovano sopra e sotto il piano di regressione sono rispettivamente in magenta e ciano. Per tutti gli esperimenti, la fase acquosa era PBS a pH 7,2. Ogni punto dati in f – h è la media di n> 3 misure dell’angolo di contatto e le barre di errore rappresentano la deviazione standard. Quando le barre di errore non sono visibili, hanno deviazioni standard più piccole dei simboli dei dati. (Per i singoli valori n, vedere la tabella supplementare 24.) I punti dati che si trovano sopra e sotto il piano di regressione sono rispettivamente in magenta e ciano. Per tutti gli esperimenti, la fase acquosa era PBS a pH 7,2. Ogni punto dati in f – h è la media di n> 3 misure dell’angolo di contatto e le barre di errore rappresentano la deviazione standard. Quando le barre di errore non sono visibili, hanno deviazioni standard più piccole dei simboli dei dati. (Per i singoli valori n, vedere la tabella supplementare 24.) I punti dati che si trovano sopra e sotto il piano di regressione sono rispettivamente in magenta e ciano. Per tutti gli esperimenti, la fase acquosa era PBS a pH 7,2. Ogni punto dati in f – h è la media di n> 3 misure dell’angolo di contatto e le barre di errore rappresentano la deviazione standard. Quando le barre di errore non sono visibili, hanno deviazioni standard più piccole dei simboli dei dati. (Per i singoli valori n, vedere la tabella supplementare 24.)
Utilizzando una stampante 3D integrata nel proprio laboratorio, i ricercatori hanno esplorato le strutture tramite reti di goccioline 3D con centinaia di goccioline incluse (PBS, diametro 100 µm, volume ≈524 pL). Ogni rete ha richiesto 224 goccioline alla frequenza di espulsione delle goccioline di 0,5 s −1 . Complessivamente, sono state valutate 129 reti stampate, ottenendo due importanti disposizioni: esagonale a pacchetto ravvicinato (hcp) e cubico centro-corpo (cc). Hanno anche classificato l’imballaggio irregolare come “amorfo” o “non imballato”.
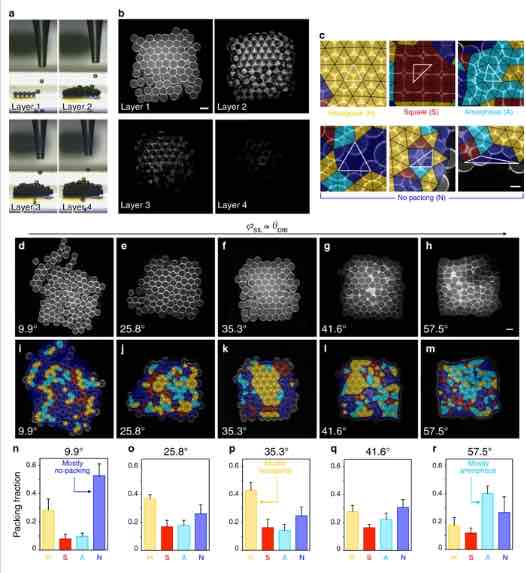
a Immagini di una rete di goccioline stampata in 3D (7 × 8 × 4 goccioline nelle direzioni x, ye z) mentre viene formato ogni strato (da 1 a 4). b Sezioni trasversali orizzontali dello strato 1 (in basso), dello strato 2, dello strato 3 e dello strato 4 di una rete di goccioline immaginate dalla microscopia confocale. I doppi strati lipidici e i monostrati sono visualizzati con Atto550M. c Esempi di tipi di imballaggio nel primo strato di reti stampate in 3D. Il nostro metodo di classificazione disegna triangoli (indicati da triangoli neri evidenziati in bianco) tra i centri di tre goccioline vicine e assegna il tipo di imballaggio locale di ciascuna tripletta in base alla geometria del triangolo (triangolazione di Delaunay). Le terzine di goccioline sono classificate come imballate in modo esagonale (giallo), quadrato (rosso) o amorfo (ciano) o non imballate (blu) (vedere “Metodi”). d – m Immagini al microscopio confocale (d – h) e sovrapposizioni dell’analisi dell’imballaggio basata sulla triangolazione di Delaunay (i – m) del primo strato di reti di goccioline stampate in 3D ad valori φSIL crescenti (corrispondenti all’aumento di IBDIB). Triangoli gialli, rossi, ciano e blu rappresentano i tipi di imballaggio definiti rispettivamente come esagonali, quadrati, amorfi e senza imballaggio. Barra della scala = 100 µm. n – r Quantificazione delle frazioni di area esagonale (gialla), quadrata (rossa), amorfa (ciano) e senza impaccamento (blu) nel primo strato di reti di goccioline stampate in 3D a valori crescenti di φSIL. In n-r, ogni barra è la media di n> 3 reti (vedere la Tabella 21 supplementare per i singoli valori n e la Figura 3 supplementare); Le barre di errore rappresentano la deviazione standard.
I risultati hanno offerto tre θ situazioni DIB- dipendenti:
θ DIB << θ c , le reti di goccioline si impacchettano liberamente con la maggior quantità di nessuna confezione
θ DIB >> θ c , le reti di goccioline si impacchettano strettamente e sono distorte, con la maggior quantità di imballaggio amorfo
θ DIB ≈ θ c , reti di gocce mostrano la maggiore quantità di imballaggio esagonale
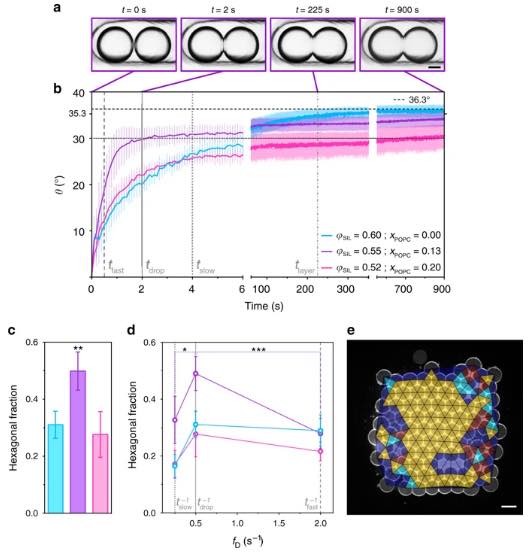
Per tutte le condizioni in a – e, IBDIB = 36.3 ° (calcolato dall’Eq. (1)). I valori φSIL e xPOPC in b – d sono φSIL = 0.60 e xPOPC = 0.00 (ciano), φSIL = 0.55 e xPOPC = 0.13 (viola) e φSIL = 0.52 e xPOPC = 0.20 (magenta). a Immagini di microscopia ottica di due goccioline (75 nL) che formano un DIB dopo il contatto. L’angolo di contatto di non equilibrio (θ) aumenta con il tempo (0-900 s) fino a raggiungere l’angolo di contatto di equilibrio (θDIB) (t = 1800 s). Barra della scala = 150 µm. Le immagini corrispondono ai punti temporali lungo il profilo viola in b. b Diagrammi di θ rispetto al tempo per le coppie di goccioline. I grafici sono la media di n = 5 ripetizioni per ogni condizione e le barre di errore rappresentano la deviazione standard. Le linee tratteggiate grigie corrispondono ai punti temporali relativi alla stampa di reti di goccioline 3D: tfast (0,50 s), tdrop (2,00 s) e tslow (4. 00 s) indicano gli intervalli di tempo tra le goccioline stampate consecutive alle frequenze di stampa rapida (tfast − 1 = 2,00 s − 1), standard (tdrop − 1 = 0,50 s − 1) e lenta (tslow − 1 = 0,25 s − 1) ; tlayer (225 s) è il tempo impiegato per stampare un singolo strato con una frequenza di stampa di 0,50 s − 1. c Un grafico a barre della frazione esagonale dell’area di imballaggio delle reti di goccioline 3D stampata con una frequenza di espulsione delle goccioline di 0,50 s − 1. La frazione di area esagonale nella condizione viola era significativamente maggiore rispetto alle altre due condizioni (ANOVA unidirezionale con il test di confronto multiplo di Tukey) (vedi Tabella Supplementare 15). d Grafici di frazioni esagonali dell’area di imballaggio nei primi strati delle reti di goccioline 3D generate a frequenze di stampa diverse (fD). Le frequenze segnate in grigio sono l’inverso dei punti temporali segnati in b (cioè, fD = tD − 1, dove tD è l’intervallo di tempo tra l’espulsione di due goccioline consecutive). Per i test statistici, vedere la Tabella supplementare 16. e Immagine microscopica confocale e sovrapposizione della triangolazione Delaunay del primo strato in una rete di goccioline stampata in 3D (7 × 8 × 4; x, y, z) a φSIL = 0,55 e xPOPC = 0,13 (condizione viola in b – d) con una frequenza di stampa di 0,50 s − 1. Barra della scala = 100 µm. Ogni punto dati nei grafici c e d è la media di n> 3 ripetizioni e le barre di errore rappresentano la deviazione standard. *, ** e *** indicano un valore p <0,05, 0,01 e 0,001, rispettivamente. Per i singoli valori n, vedere le tabelle supplementari 22 e 23. e Un’immagine microscopica confocale e sovrapposizione della triangolazione Delaunay del primo strato in una rete di goccioline stampata in 3D (7 × 8 × 4; x, y, z) a φSIL = 0,55 e xPOPC = 0,13 (condizione viola in b – d) con una frequenza di stampa di 0,50 s − 1. Barra della scala = 100 µm. Ogni punto dati nei grafici c e d è la media di n> 3 ripetizioni e le barre di errore rappresentano la deviazione standard. *, ** e *** indicano un valore p <0,05, 0,01 e 0,001, rispettivamente. Per i singoli valori n, vedere le tabelle supplementari 22 e 23. e Un’immagine microscopica confocale e sovrapposizione della triangolazione Delaunay del primo strato in una rete di goccioline stampata in 3D (7 × 8 × 4; x, y, z) a φSIL = 0,55 e xPOPC = 0,13 (condizione viola in b – d) con una frequenza di stampa di 0,50 s − 1. Barra della scala = 100 µm. Ogni punto dati nei grafici c e d è la media di n> 3 ripetizioni e le barre di errore rappresentano la deviazione standard. *, ** e *** indicano un valore p <0,05, 0,01 e 0,001, rispettivamente. Per i singoli valori n, vedere le tabelle supplementari 22 e 23.
Con l’ aggiunta di 1-palmitoil-2-oleoil- sn -glicerero-3-fosfocolina (POPC) ai lipidi, inizialmente l’equilibrio dell’angolo di contatto era rapido, ma seguito da una fase più lenta. Lo studio ha confermato che:
“… La regolarità dell’hcp nelle reti di goccioline stampate in 3D era ottimale quando θ DIB ≈ θ c , e anche quando la frequenza di stampa e la cinetica della formazione DIB erano abbinate per consentire la formazione iniziale del normale imballaggio esagonale 2D nel primo strato , che poi ha modellato hcp quando i livelli successivi sono stati stampati in alto. “
Per le regioni hcp, si sono formati dodecaedri trapezo-rombici che riempiono lo spazio, costituiti da 12 DIB e goccioline periferiche.

a – c Immagini al microscopio a campo chiaro di una rete di goccioline stampate in 3D (10 × 12 × 4; x, y, z) (1 mM DPhPC, φSIL = 0.60 e un θDIB calcolato = 36.3 ° dalla Figura 5b supplementare) comprendente una fase acquosa al 20% (p / v) di poli (etilenglicole) diacrilato, 0,5% (p / v) Irgacure 2959 (foto-iniziatore), 100 µM di etidio bromuro-N, N’-bisacrilammide (foto-croce- fluoroforo collegabile) e PBS, prima (a) e dopo (b) foto-polimerizzazione con luce UV. Barre di scala = 100 µm. c L’immagine di un cluster hcp di poliedri di idrogel dispersi in PBS. Barra della scala = 25 µm. d Ricostruzione 3D delle forme di goccioline dalla microscopia confocale della regione hcp in c, che conteneva 14 goccioline raggruppate (Supplementary Movie 1). e, f Un modello al computer di un dodecaedro trapezo-rombico — il poliedro che riempie lo spazio dell’imballaggio esagonale ravvicinato — visto dal basso (e) (confronta la scatola bianca in d) e sopra (f). g – i Una gocciolina sezionata attraverso l’asse z dal basso verso l’alto, con (inserto) modelli computerizzati di dodecaedri trapezo-rombici che mostrano sezioni 2D di simmetria tripla (g, i) e sei volte (h).
“I nostri risultati sono applicabili a qualsiasi altro gruppo di sistemi compartimentati – come vescicole uni-lamellari giganti adesive o compartimenti proteici – in cui è richiesto l’ordine strutturale per costruire tessuti sintetici con funzionalità precise”, ha concluso il team di ricerca, confermando che possono 3D stampa reti di goccioline con design complessi e ad alta risoluzione, come strutture tubolari.
“Questo livello di precisione non è stato raggiunto alla periferia dei costrutti stampati in 3D, dove la maggior parte dei difetti di stampa e le disposizioni irregolari delle goccioline erano confinate. Tuttavia, le nostre osservazioni suggeriscono anche che l’imballaggio regolare alla periferia delle reti di goccioline stampate in 3D potrebbe essere ulteriormente migliorato mediante fasi di “ricottura” dopo il processo di stampa (ovvero riduzione ciclica e aumento degli angoli di contatto) o templatura del reticolo di imballaggio delle goccioline usando superfici modellate. “
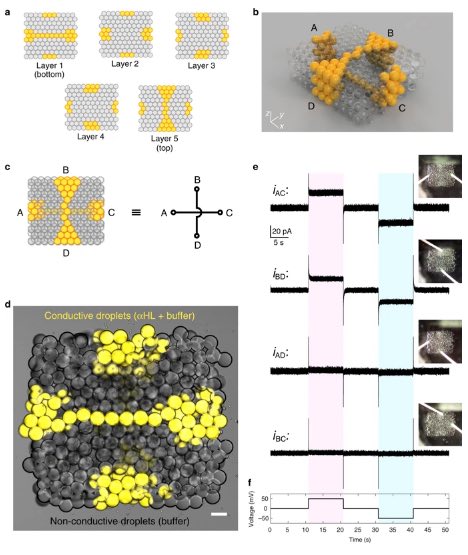
a Mappe del primo (in basso), del secondo, del terzo, del quarto e del quinto (in alto) strato di un tessuto sintetico stampato in 3D in cui due percorsi conduttivi a goccia singola contenenti αHL (in giallo) sono modellati in 3D all’interno di un rete di goccioline non conduttive (in grigio). b Un modello computerizzato che visualizza l’architettura 3D del tessuto sintetico. I due percorsi a goccia singola attraversano il tessuto sintetico, uno in orizzontale nella parte inferiore (che collega A a C) e uno in verticale nella parte superiore (che collega B a D) della rete. c Schema semplificato del tessuto sintetico e modello di circuito equivalente. d Sovrapposizione di microscopia a campo chiaro e fluorescente del tessuto sintetico. Le goccioline nei percorsi conduttivi a goccia singola contenevano α-emolisina (60 µg mL − 1), 25 mM Tris-HCl (pH 7,6), 1 M NaCl e 10 µM Atto488 fluoroforo (falsi colori in giallo). Barra della scala = 100 µm. e Registrazioni elettriche delle correnti ioniche che fluiscono attraverso i due percorsi conduttivi a goccia singola collegando A a C (iAC) e da B a D (iBD) su applicazione del protocollo di tensione mostrato in f. Quando è stato applicato un potenziale di ± 50 mV, sono state osservate variazioni delle correnti ioniche di +25,6 ± 1,4 pA (a potenziale positivo) e −25,6 ± 1,5 pA (a potenziale negativo) per iAC, e di +19,4 ± 1,2 pA (a potenziale positivo) e −19,8 ± 1,3 pA (a potenziale negativo) per iBD. Al contrario, abbiamo registrato variazioni non significative della corrente ionica per gli stessi potenziali applicati tra A e D (iAD) o B e C (iBC). iAD: +1,8 ± 1,3 pA e −1,8 ± 1,4 pA (rispettivamente a potenziale positivo e negativo); iBC: +0,9 ± 1,1 pA e −0,9 ± 1,1 pA (rispettivamente a potenziale positivo e negativo). e Registrazioni elettriche delle correnti ioniche che fluiscono attraverso i due percorsi conduttivi a goccia singola collegando A a C (iAC) e da B a D (iBD) su applicazione del protocollo di tensione mostrato in f. Quando è stato applicato un potenziale di ± 50 mV, sono state osservate variazioni delle correnti ioniche di +25,6 ± 1,4 pA (a potenziale positivo) e −25,6 ± 1,5 pA (a potenziale negativo) per iAC e di +19,4 ± 1,2 pA (a potenziale positivo) e −19,8 ± 1,3 pA (a potenziale negativo) per iBD. Al contrario, abbiamo registrato variazioni non significative della corrente ionica per gli stessi potenziali applicati tra A e D (iAD) o B e C (iBC). iAD: +1,8 ± 1,3 pA e −1,8 ± 1,4 pA (rispettivamente a potenziale positivo e negativo); iBC: +0,9 ± 1,1 pA e −0,9 ± 1,1 pA (rispettivamente a potenziale positivo e negativo). e Registrazioni elettriche delle correnti ioniche che fluiscono attraverso i due percorsi conduttivi di una singola goccia che collegano A a C (iAC) e da B a D (iBD) su applicazione del protocollo di tensione mostrato in f. Quando è stato applicato un potenziale di ± 50 mV, sono state osservate variazioni delle correnti ioniche di +25,6 ± 1,4 pA (a potenziale positivo) e −25,6 ± 1,5 pA (a potenziale negativo) per iAC, e di +19,4 ± 1,2 pA (a potenziale positivo) e −19,8 ± 1,3 pA (a potenziale negativo) per iBD. Al contrario, abbiamo registrato variazioni non significative della corrente ionica per gli stessi potenziali applicati tra A e D (iAD) o B e C (iBC). iAD: +1,8 ± 1,3 pA e −1,8 ± 1,4 pA (rispettivamente a potenziale positivo e negativo); iBC: +0,9 ± 1,1 pA e −0,9 ± 1,1 pA (rispettivamente a potenziale positivo e negativo).