Stampa 3D con Ti6Al4V poroso per impianti dentali migliorati
Poiché gli impianti continuano a rappresentare una sfida per i pazienti dentali, i ricercatori di Taiwan stanno sperimentando modi migliori per correggere i difetti ossei dopo la rimozione degli impianti falliti. I risultati del loro studio sono delineati in ” impianti dentali porosi Ti 6 Al 4 V stampati in 3D per un supporto osseo compromesso “.
La mancanza di osso alveolare adatto e di supporto è un problema comune per i pazienti odontoiatrici con impianti falliti, e in particolare per quelli che hanno sviluppato un’infiammazione con la perimplantite. I difetti possono causare meno attaccamento e rigenerazione ossea, insieme a un miglioramento clinico ridotto. Con l’ingegneria del tessuto osseo tramite bioprinting (qui, gli impianti Bio-ActiveITRIdental sono stati fabbricati con il sistema EOSINT M 280 ), gli autori prevedono una serie di nuove possibilità per i pazienti attraverso la capacità di creare scaffold per tessuti con caratteristiche come:
Architettura interna
Porosità
Interconnettività
Dimensioni specifiche del paziente
Gli impianti sono stati testati su conigli, con i campioni disponibili sia per la radiografia che per la valutazione TC, insieme all’analisi biomeccanica. La crescita ossea è stata testata in diverse posizioni dell’impianto, con ciascuna area valutata. I test biomeccanici hanno mostrato l’effetto delle risposte istologiche sugli impianti, insieme a un “aumento progressivo” della forza in relazione alla crescita ossea, insieme alla mineralizzazione e alla maturazione del tessuto ingegnerizzato. Gli impianti con una superficie più ruvida tendevano a mostrare una migliore osteointegrazione, rispetto ai campioni del gruppo di controllo con superfici più lisce.
La rigidità si è verificata a causa della tecnica di sinterizzazione in polvere, responsabile anche della creazione di una rete di strutture porose. Anche i test di compressione e fatica hanno dimostrato proprietà adeguate, consentendo al team di ricerca di scendere a compromessi tra proprietà meccaniche e interconnettività dei pori. Allargando la larghezza dei pori su nanoscala, gli autori sono stati anche in grado di aumentare le caratteristiche di bioattività e accelerare l’osteogenesi. La rugosità superficiale è rimasta la stessa.
“Sebbene la fabbricazione di impianti dentali in lega di Ti con una struttura di impalcatura porosa definita sia una strategia promettente per migliorare l’osteoinduzione degli impianti, in uno studio che utilizza la tecnica di stampa 3D di fusione del raggio laser per fabbricare impianti dentali Ti6Al4V porosi con tre dimensioni dei pori controllate (200, 350 e 500 mm ), gli impianti con dimensioni dei pori di 350 e 500 mm dimostrano una migliore biocompatibilità in termini di crescita cellulare, migrazione e adesione “, hanno concluso i ricercatori. “La dimensione dei pori di 350 mm offre un potenziale ottimale e un potenziale ottimale per migliorare la schermatura meccanica delle ossa circostanti e l’osteoinduzione dell’impianto stesso.
“Ulteriori studi sull’effetto di diverse dimensioni dei pori e porosità senza sacrificare le loro proprietà meccaniche sono obbligatori per ottimizzare il risultato clinico.”
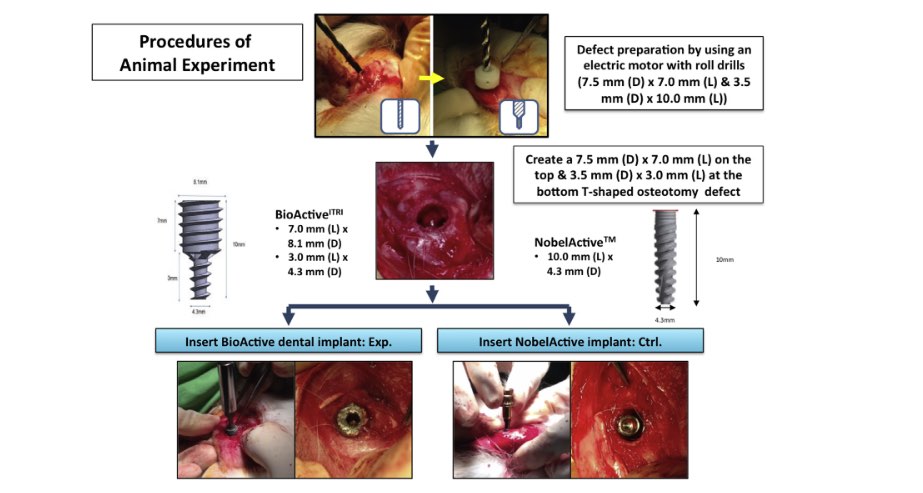
Procedure di esperimento su animali. Il difetto dell’osteotomia (a forma di T; 7,5 mm (D) – 7,0 mm (L) nella parte superiore e 3,5 mm (D) – 3,0 mm (L) nella parte inferiore) è stato preparato sull’aspetto laterale del condilo femorale distale della Nuova Zelanda coniglio bianco. Entrambe le parti sono state inserite casualmente con gli impianti NobelActiveäim (gruppo di controllo) o gli impianti mentali Bio-ActiveITRI (gruppo ITRI). A 4,8 e 12 settimane dopo l’inserimento dell’impianto, gli animali sono stati sacrificati mediante iniezione di pentobarbital. 
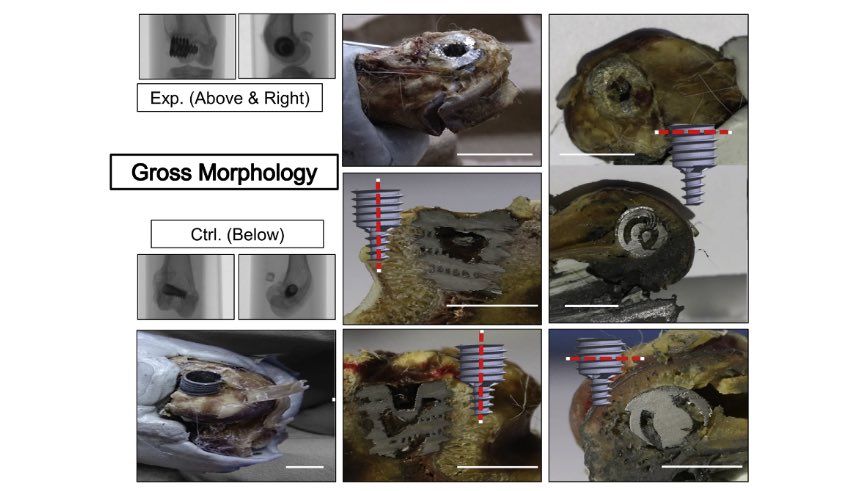
Analisi morfologica lorda. Il campione di controllo (tre immagini inferiori del pannello sinistro) mostrava la proliferazione del tessuto fibroso nella regione coronale degli impianti senza fissazione sicura tra l’impianto e il tessuto osseo circostante. Il campione ITRI esperienziale (due immagini del pannello di sinistra e immagini dei due di destra) mostrava la proliferazione ossea attiva e la penetrazione di nuovo osso nelle strutture porose degli impianti. BarZ4.3 mm nelle immagini di controllo; BarZ8,1 mm in immagini sperimentali. 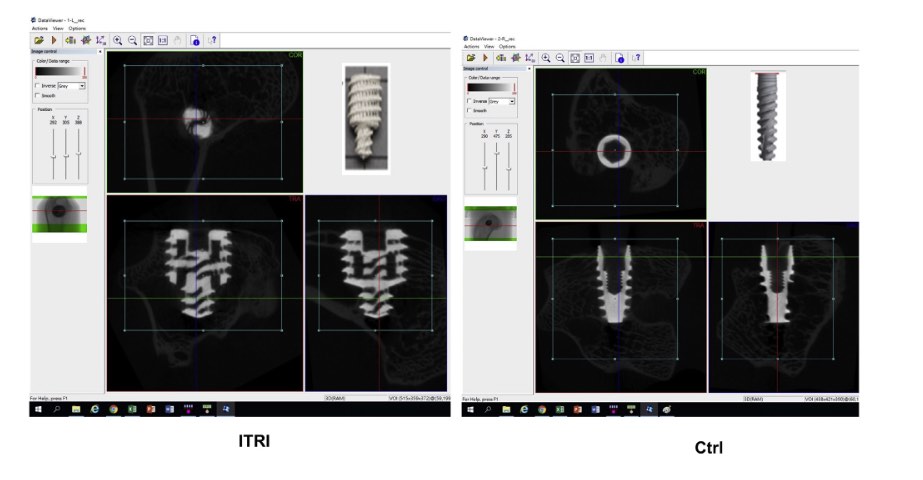
Analisi micro-CT. Le radiografie della parte distale del femore sono state eseguite con il suo orientamento sia perpendicolare che parallelo all’asse lungo dell’asse lungo dell’impianto e quindi i soggetti sono stati posizionati nello scanner micro-CT in un orientamento cra-niocaudale con stabilizzazione adeguata. I set di dati sono stati ricostruiti utilizzando il software CTvox 2.4. Volume del tessuto (TV: mm3), volume osseo (BV: mm3), percentuale del volume osseo (BV / TV:%), spessore trabecolare (Tb.Th: mm), separazione trabecolare (Tb.Sp: mm), totale sono state analizzate la porosità [Po (tot):%], il rapporto tra la superficie ossea segmentata e il volume totale della regione di interesse (superficie ossea / volume del tessuto; cioè, densità della superficie ossea) e la superficie dell’interfaccia; mentre i risultati della densità minerale ossea (BMD) sono stati espressi in mg / cm3.