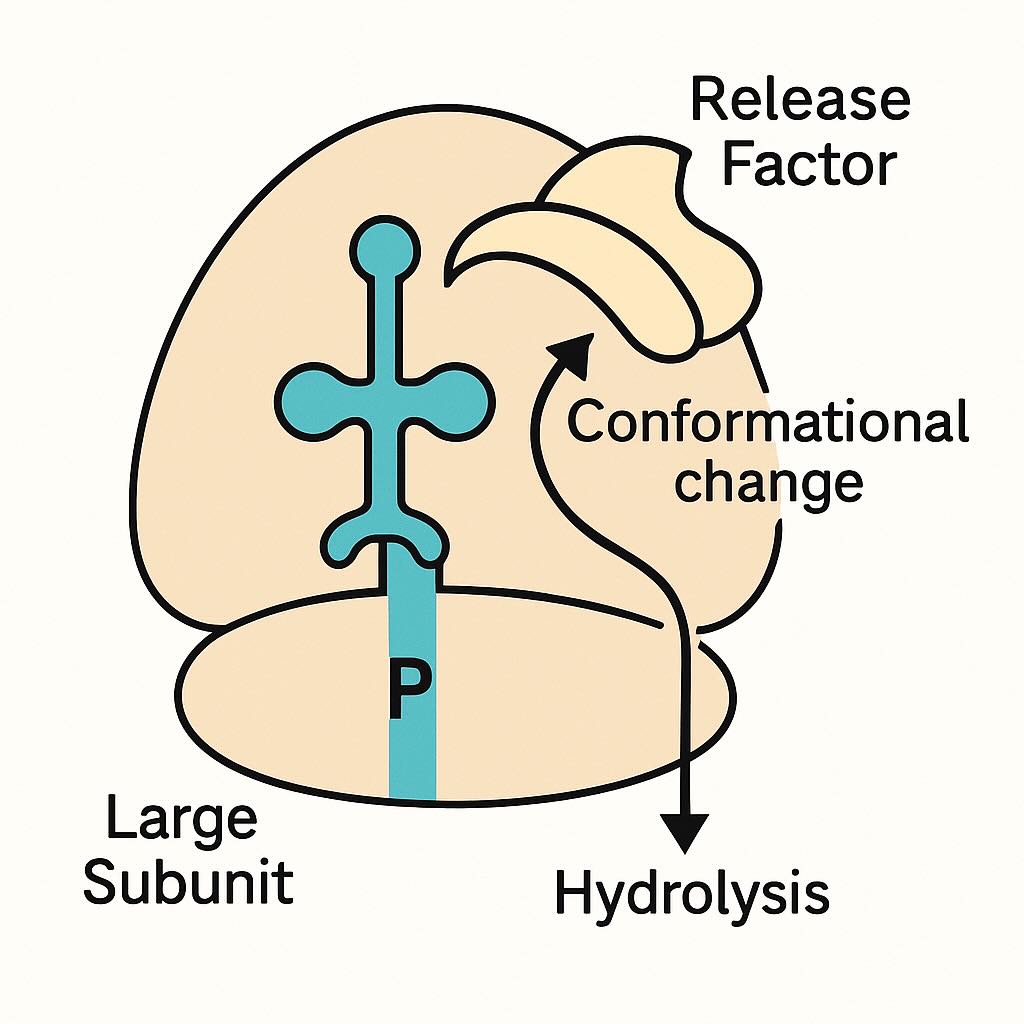
Meccanismo di rilascio della proteina nel ribosoma
Un gruppo di ricerca dell’University of Illinois Chicago (UIC) ha studiato il processo con cui il ribosoma rilascia la catena polipeptidica al termine della traduzione. La comprensione classica attribuiva esclusivamente a una molecola d’acqua il compito di interrompere il legame tra proteina e tRNA. Il nuovo lavoro dimostra invece che interviene direttamente il fattore di rilascio, modificando la struttura del tRNA fino a favorire l’idrolisi .
Il contesto della scoperta
Il ribosoma legge il messaggio genico nell’mRNA traducendo i codoni in aminoacidi e concatenandoli in una catena proteica. Al raggiungimento di un codone di stop, un release factor occupa il sito di attività e dà inizio alla reazione di idrolisi che libera la proteina finita. Fino a oggi si pensava che la molecola d’acqua, semplicemente presente nel sito catalitico, fosse sufficiente per rompere il legame. L’esperimento UIC spiega perché questa rottura non avvenga in modo accidentale durante la sintesi .
Approccio sperimentale
Per rallentare e osservare la fase di rilascio, il team UIC ha creato un analogo non idrolizzabile del legame tRNA-proteina. Utilizzando cristallografia a raggi X ad alta risoluzione, i ricercatori hanno ottenuto immagini dettagliate del complesso ribosomiale poco prima della reazione di rilascio. Tali immagini hanno rivelato l’assenza di molecole d’acqua pronte alla rottura del legame .
Il ruolo del release factor
Il rilascio non dipende dal vettore idrico, ma da un cambiamento conformazionale indotto dal release factor. Quest’ultimo “sposta” un segmento del tRNA in modo che sia proprio la molecola di trasporto ad attivare l’idrolisi, rompendo il legame con la catena polipeptidica. In questo modo il processo diventa strettamente controllato e avviene solo al segnale di stop codon .
Implicazioni biologiche e sanitarie
La precisione del rilascio proteico è cruciale per evitare concatenazioni errate o premature, che possono generare proteine difettose responsabili di patologie come la fibrosi cistica o la distrofia muscolare di Duchenne. La nuova conoscenza offre basi molecolari per lo sviluppo di farmaci che modulino specificamente il termine della traduzione in caso di mutazioni nei codoni di stop.
Prospettive future
Il meccanismo scoperto appare conservato in batteri e cellule umane, suggerendo un’applicabilità universale. Passi successivi prevedono lo studio di altri fattori di rilascio e l’uso di tecniche di dinamica molecolare per monitorare in tempo reale il cambiamento conformazionale del tRNA durante il ciclo di traduzione.