Ricerca a Pretoria: un sostituto cutaneo “pronto per la biostampa” per ferite che guariscono per seconda intenzione
Alla University of Pretoria (UP), in Sudafrica, una linea di ricerca nata in ambito accademico sta affrontando un problema clinico molto concreto: la gestione di ferite complesse che non possono essere chiuse chirurgicamente e devono guarire per seconda intenzione, come ustioni estese e ulcere croniche. In questo contesto, la farmacologa Dr Hafiza Parkar (Department of Pharmacology, Faculty of Health Sciences) ha sviluppato un materiale sostitutivo della pelle pensato come base per realizzare, in prospettiva, strutture cutanee biostampate in 3D e personalizzate sul paziente.
Perché gli innesti cutanei non bastano in molti casi
Gli innesti restano una soluzione centrale nella pratica clinica, ma incontrano limiti ricorrenti: disponibilità di tessuto donatore, rischio di complicanze e fattori legati al paziente (ad esempio comorbidità che rallentano la cicatrizzazione). Il progetto UP nasce proprio per proporre un’alternativa che riduca alcuni di questi vincoli, creando un supporto “tipo pelle” su cui il corpo possa rigenerare tessuto sano, e che allo stesso tempo possa diventare “stampabile” con tecniche di bioprinting.
Il cuore dell’approccio: “Acellular Dermal Scaffold” e decellularizzazione
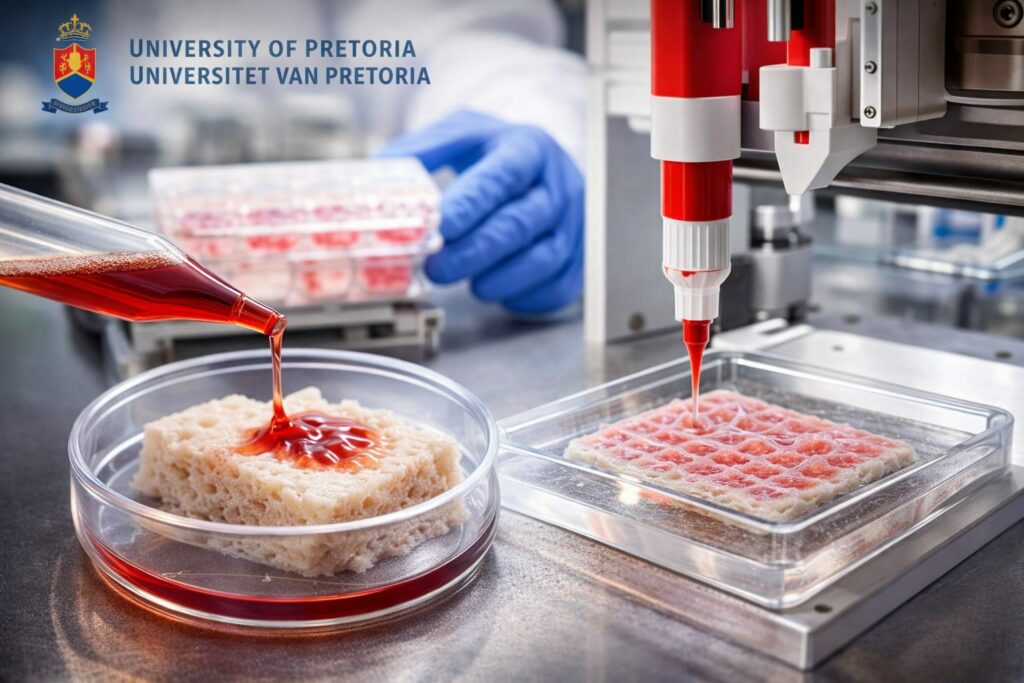
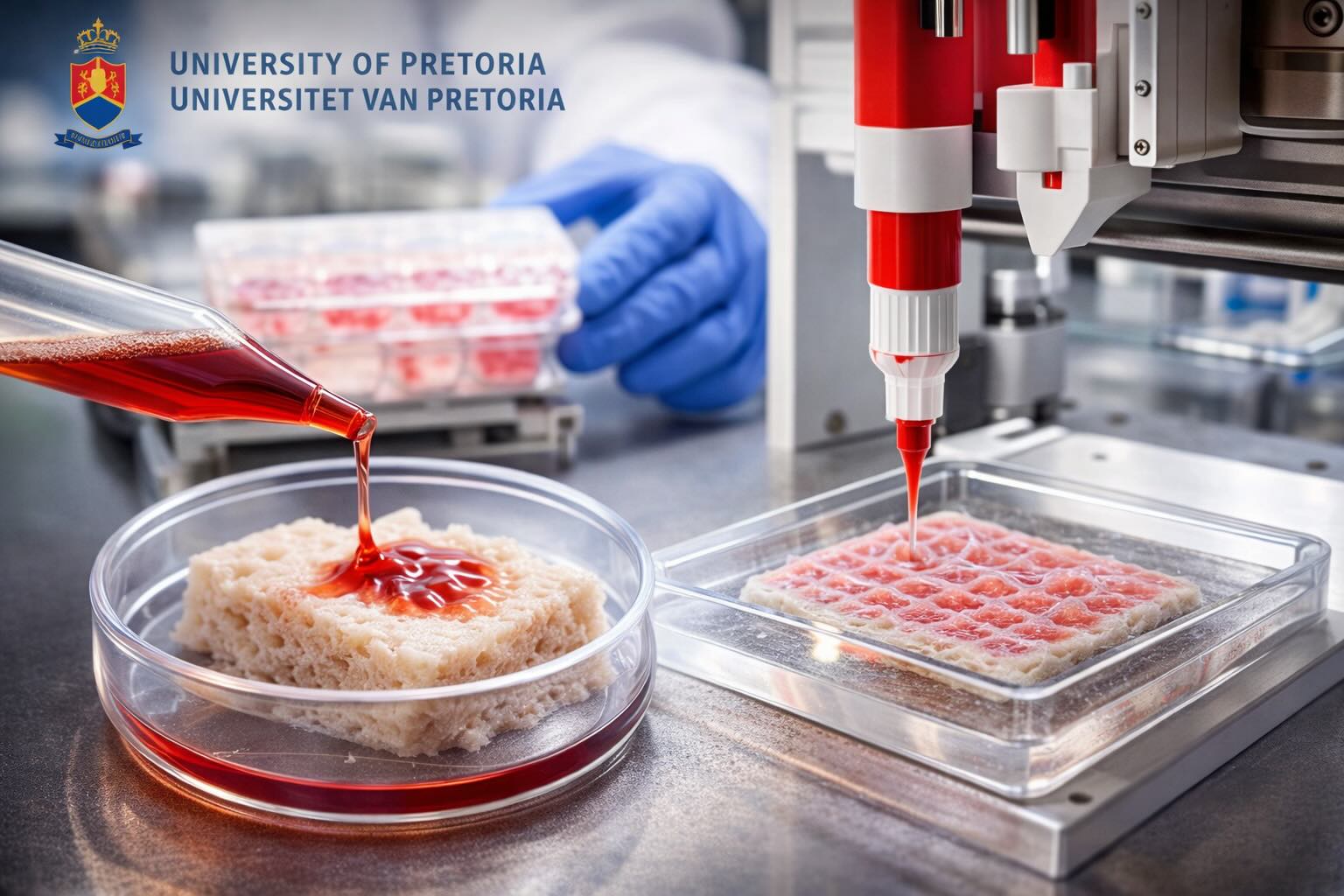
Il materiale sviluppato a Pretoria viene descritto come acellular dermal scaffold (ADS): un’impalcatura dermica ottenuta rimuovendo cellule e componenti potenzialmente immunogeniche (processo di decellularizzazione), con l’obiettivo di preservare quanto più possibile la matrice extracellulare (ECM), cioè la struttura e i segnali biochimici che guidano adesione, migrazione e organizzazione cellulare durante la riparazione dei tessuti. L’idea è ridurre la probabilità di rigetto rispetto a soluzioni con maggiore carico cellulare “estraneo”, mantenendo però un ambiente favorevole alla rigenerazione.
Cosa significa “mimetico della pelle” dal punto di vista tecnico
Quando si parla di scaffold dermici “che imitano la pelle”, non si intende solo una forma: conta la combinazione di microstruttura, porosità, resistenza meccanica e “messaggi” biologici della ECM (collagene, elastina, glicosaminoglicani e altre componenti) che influenzano la qualità della guarigione. La letteratura sui dermal scaffold sottolinea che replicare il microambiente della riparazione cutanea è una delle chiavi per ottenere rigenerazione più ordinata e, potenzialmente, ridurre esiti cicatriziali sfavorevoli.
I risultati preclinici: guarigione più rapida in modelli animali e test con PRP
Secondo le comunicazioni ufficiali dell’ateneo, gli ADS sviluppati nel progetto hanno mostrato guarigione accelerata in modelli animali, sia utilizzati da soli sia in combinazione con plasma ricco di piastrine (PRP). Il razionale del PRP è noto in ambito rigenerativo: fornisce un mix di fattori e mediatori che possono sostenere angiogenesi e rimodellamento, e diversi studi sperimentali (su ADM/ADS) hanno valutato proprio l’effetto dell’aggiunta di PRP su vascolarizzazione e integrazione del graft.
Dal sostituto cutaneo alla biostampa 3D: cosa va “tradotto” nel processo
Il passaggio cruciale, evidenziato anche dall’articolo originale, è trasformare l’ADS in una piattaforma compatibile con bioprinting 3D: significa progettare un materiale che possa essere depositato/assemblato con geometrie controllate e, quando serve, combinato con componenti cellulari. In prospettiva, l’obiettivo dichiarato è arrivare a costrutti su misura per dimensione e geometria della ferita e, potenzialmente, caricati con cellule del paziente. In parallelo, il team UP cita una collaborazione con ricercatori in forensic anthropology per lavorare sulla resa geometrica e sull’adattamento a ferite individuali, cioè l’aspetto “patient-specific” del percorso.
Personalizzazione: dimensioni, profondità, geometria e tempi clinici
In medicina delle ferite, la personalizzazione non è un dettaglio estetico: profondità irregolari, cavità, bordi sfiancati e tessuti con perfusione compromessa rendono difficile ottenere contatto uniforme e stabilità meccanica del materiale applicato. L’idea di usare la biostampa come “step successivo” all’ADS è proprio controllare in modo più fine la forma finale del sostituto, riducendo adattamenti manuali in sala o in ambulatorio e puntando a una ripetibilità più alta di preparazione e applicazione.
Cosa resta da validare prima dell’uso clinico su larga scala
Come per molti approcci basati su ECM decellularizzata, i nodi tecnici e regolatori includono: standardizzazione del processo di decellularizzazione (per evitare residui cellulari), controllo delle proprietà meccaniche lotto-per-lotto, sterilizzazione senza degradare la ECM, e dimostrazione di sicurezza/efficacia in percorsi preclinici e clinici robusti. Le review recenti sugli scaffold acellulari sottolineano che la qualità della decellularizzazione e la coerenza produttiva sono tra i fattori che determinano la traducibilità clinica.