I ricercatori dell’Istituto Federale Svizzero di Tecnologia di Losanna (EPFL) hanno sviluppato un approccio per stampare tessuti su scala centimetrica con elevata rilevanza fisiologica, che appaiono e funzionano quasi come la loro controparte in vivo a grandezza naturale . I mini-tessuti ingegnerizzati potrebbero consentire agli scienziati di studiare i processi biologici e persino di testare nuovi approcci terapeutici in modi che prima non erano possibili, aprendo nuove strade per la scoperta di farmaci, la diagnostica e la medicina rigenerativa.
In uno studio pubblicato nel settembre 2020 sulla rivista Nature Materials , i ricercatori hanno riportato la progettazione di un set-up personalizzato di bioprinting in modalità di estrusione costituito da un microscopio e un dispositivo in grado di aspirare e depositare cellule attraverso un ugello sottile accoppiato a una pompa a siringa . L’approccio, chiamato bioprinting-assisted tissue emergence (BATE), utilizza cellule staminali che formano organoidicome elementi costitutivi che possono essere depositati direttamente in matrici extracellulari favorevoli all’auto-organizzazione spontanea. Spostando il tavolino del microscopio e monitorando costantemente il processo attraverso la lente del microscopio, i ricercatori sono stati in grado di depositare nel gel una linea di cellule staminali intestinali che misurava pochi centimetri di lunghezza.
Ad oggi, i ricercatori sono stati in grado di progettare organoidi che somigliano al cervello, allo stomaco, ai reni, ai polmoni e al fegato , facilitando lo sviluppo di nuove strategie terapeutiche e il progresso della medicina personalizzata. Tuttavia, l’EPFL ha riferito che gli approcci convenzionali alla crescita degli organoidi comportano l’assemblaggio delle cellule staminali in sfere cave di dimensioni da micro a millimetriche.
Inoltre, secondo Matthias Lütolf, professore presso l’Istituto di bioingegneria dell’EPFL e autore principale dello studio, questo approccio è “non fisiologico”, perché molti organi, come l’intestino o le vie aeree, sono a forma di tubo e molto più grandi. Per sviluppare organoidi più grandi che assomigliano alle loro controparti normali, Lütolf e il suo team si sono rivolti alla bioprinting.
Sebbene gli scienziati abbiano prodotto organoidi coltivati in laboratorio per decenni , i progressi nelle aree della biotecnologia, come l’ingegneria dei tessuti, i biomateriali e la biofabbricazione hanno accelerato la ricerca sugli organoidi, consentendo lo sviluppo di sistemi biologici complessi.
“La bioprinting è molto avvincente perché ti consente di depositare cellule ovunque nello spazio 3D, quindi potresti pensare di disporre le cellule in una configurazione simile a un organo come un tubo”, ha detto Lütolf. “Con i metodi tradizionali per la crescita degli organoidi, puoi coltivare sia gli organoidi dello stomaco che gli organoidi intestinali, mentre, con la bioprinting, puoi combinare diversi tipi di cellule e disporli in modi diversi”.
Inoltre, ciò che rende l’approccio di nuova concezione diverso da altri metodi per coltivare organoidi è che combina la flessibilità e la precisione della stampa 3D con la capacità delle cellule staminali di crescere e organizzarsi. In quello che Lütolf ha descritto come “permettere alla biologia di accadere”, qualcosa che considera “assolutamente cruciale”.
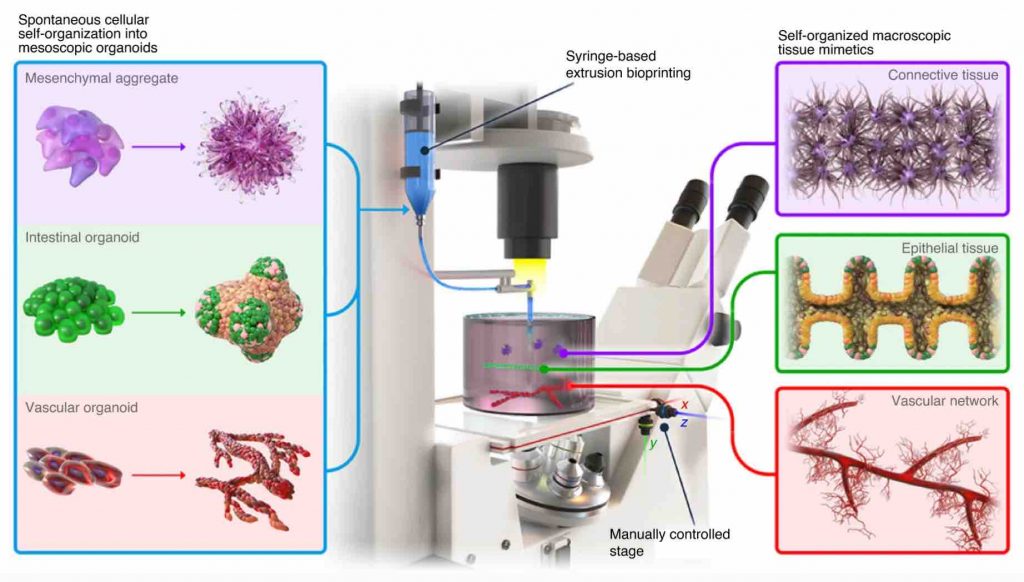
Metodo di bioprinting BATE che utilizza elementi costitutivi auto-organizzati spontaneamente per creare tessuti su larga scala. Immagine per gentile concessione dell’EPFL.
Inoltre, i ricercatori hanno scoperto che affidarsi alla bioprinting basata sul microscopio riduceva la necessità di competenze approfondite sulla reologia dell’idrogel e sulla formulazione del bioink, poiché facilitava l’ottimizzazione della stampa fornendo un feedback diretto dell’utente per il controllo visivo e la modulazione del processo di stampa in tempo reale. La versatilità di BATE si vede anche nella sua capacità di controllare la deposizione sequenziale di cellule di supporto spazialmente e temporalmente, poiché l’integrazione del bioprinter in un microscopio automatizzato rende possibile tracciare l’emergenza del tessuto in tempo reale e, se lo si desidera, tornare a posizioni specifiche per posizionare con precisione altri tipi di cellule, hanno descritto gli scienziati.
“In altri approcci di bioprinting, non vedi cosa sta succedendo. La cosa bella dell’utilizzo di un microscopio è che puoi sempre vedere quello che stai facendo e puoi guardare cosa fanno le cellule – non sei cieco “, ha continuato Lütolf.
Una volta seminate le cellule staminali, le cellule hanno iniziato a crescere e interagire tra loro, formando un tessuto continuo a forma di tubo che imitava molte delle caratteristiche anatomiche e funzionali di un intestino normale, ha suggerito lo studio. Risultati simili sono stati ottenuti con il colon primario del topo e le cellule staminali dello stomaco, nonché con le cellule staminali del colon umane, indicando che BATE può essere ampiamente applicabile agli organoidi derivati da cellule staminali epiteliali.
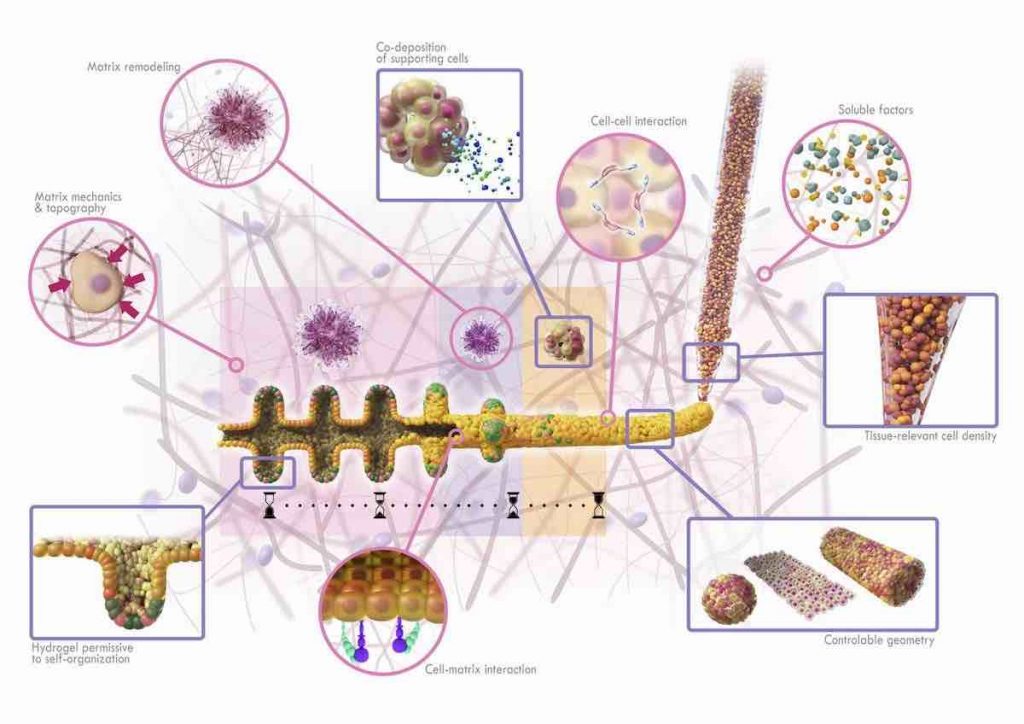
BATE applicato all’ingegneria dei tessuti intestinali. Un controllo robusto sulla densità cellulare e sulla geometria dei tessuti può essere ottenuto direttamente all’interno di ambienti che consentono l’auto-organizzazione multicellulare. Immagine per gentile concessione dell’EPFL.
Le budella coltivate in laboratorio, che raggiungevano le dimensioni fino a tre centimetri, erano composte da sacche a forma di cripta con cellule staminali e contenevano le stesse cellule assorbenti e secretorie specializzate di quelle che si trovano in un intestino a grandezza naturale. Le cellule secretorie dei mini intestini erano anche in grado di secernere molecole antimicrobiche in risposta a stimoli specifici.
Lütolf ha anche osservato che con i metodi tradizionali per la crescita degli organoidi, i ricercatori possono coltivare organoidi dello stomaco o organoidi intestinali, mentre, con la bioprinting , sono stati in grado di combinare diversi tipi di cellule e disporli in modi diversi. In particolare, BATE ha consentito la stampa sequenziale di più tipi di cellule per formare geometrie complesse e disposizioni di tipi di cella con una buona risoluzione spaziale.
Nello studio, i ricercatori sono stati in grado di mostrare come questo concetto di fusione organoide possa essere utilizzato per produrre tessuti su scala relativamente grande utilizzando blocchi di costruzione identici, oltre a imitare i confini dei tessuti utilizzando blocchi di organi correlati. Inoltre, gli autori hanno ritenuto che il loro approccio originale di stampa cellulare per guidare la morfogenesi dei tessuti su scale diverse presenta numerosi vantaggi rispetto ad altre tecnologie di bioprinting esistenti.

I risultati dello studio hanno mostrato che BATE ha consentito alle cellule fragili, come le cellule staminali primarie, di organizzarsi in una geometria complessa direttamente all’interno delle più potenti matrici di coltura 3D, come quella utilizzata nello studio, Matrigel. Ha anche ridotto i tempi di stampa e la complessità geometrica perché l’architettura microscopica dei costrutti finali è stata creata dalle cellule durante il successivo rimodellamento e auto-organizzazione.
Sebbene lo studio fornisca un nuovo strumento per l’ingegneria dei tessuti auto-organizzati e per imitare i confini degli organi, Lütolf ritiene che il loro uso nella medicina rigenerativa , inclusa la sostituzione di tessuti e organi umani, sia ancora lontano anni. Ma ha notato che l’approccio recentemente sviluppato potrebbe essere utilizzato per costruire modelli di tessuto per malattie umane, incluso il cancro, e per testare come i farmaci candidati agiscono su specifici tipi di cellule all’interno di un tessuto.