Il dispositivo monolitico stampato in 3D funge da trappola per isolare le cellule tumorali
Ricercatori internazionali hanno recentemente sviluppato un metodo per catturare le cellule del sangue per isolare i tumori, utilizzando un nuovo dispositivo per biopsia liquida che funziona come una trappola per cellule stampata in 3D.
Questa tecnica viene utilizzata nella ricerca per il trattamento del cancro come un modo migliore per colpire le cellule tumorali, che può essere difficile da trovare (e spesso per consentire una diagnosi), oltre a monitorare l’ulteriore diffusione delle cellule tumorali se metastatizzano.
Per metterlo in prospettiva, è importante capire che le poche cellule tumorali ricercate potrebbero essere nascoste in miliardi di altre cellule del sangue. La trappola stampata in 3D trova queste cellule mentre i globuli bianchi vengono tenuti all’interno e i globuli rossi vengono filtrati nuovamente. Sebbene siano stati utilizzati metodi precedenti, nella maggior parte dei casi mancano di efficienza e danneggiano le cellule nella trappola.
“Catturare queste cellule tumorali è di per sé una grande sfida”, afferma il ricercatore Fatih Sarioglu. “Poiché ci sono miliardi di cellule del sangue, hai bisogno di uno strumento di ingegneria, una tecnologia in grado di schermare le cellule una per una. Non puoi perdere nemmeno una cella. Le tecniche di laboratorio tipiche non funzionano.
“L’altro problema è che le cellule tumorali mutano costantemente, quindi non puoi fare affidamento su un tipo di marcatore per distinguerle dalle altre cellule, anche dalle cellule del sangue, e talvolta possono nascondersi in modo molto efficiente tra le cellule del sangue.”
Composta da 32 strati microfluidici, la trappola cellulare misura 100 mm x 20,5 mm x 19,2 mm ed è completamente dettagliata nell’arricchimento negativo ibrido di cellule tumorali circolanti dal sangue intero in un dispositivo monolitico stampato in 3D , con Chia- Heng Chu come autore principale.
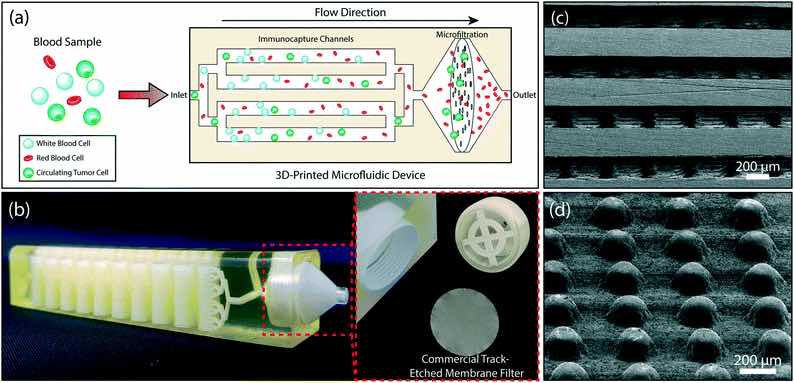
Il design del dispositivo microfluidico stampato in 3D. (a) Uno schema che mostra il processo di arricchimento delle cellule tumorali nel dispositivo. Il sangue intero viene introdotto nel dispositivo. I globuli bianchi vengono catturati nei canali di immunocapture multistrato. Un filtro a membrana trattiene tutte le cellule nucleate (compresi i globuli bianchi residui) ed elimina le cellule del sangue anucleate. (b) Una foto del dispositivo stampato in 3D che mostra i canali microfluidici con 32 strati microfluidici impilati e il portafiltro (a destra). È possibile accedere al filtro a membrana rimuovendo il tappo filettato (a sinistra). (c) Una microfotografia elettronica a scansione della sezione trasversale del dispositivo che mostra microposti da 200 μm di diametro all’interno degli strati microfluidici. (d) I micropillari allineati, all’interno di ogni strato, sono spostati di 10 μm da una riga all’altra per massimizzare le interazioni cellula-micropost.
Il dispositivo funziona con due diverse sezioni: una sezione di acquisizione dei leucociti a base di immunoaffinità multistrato e una sezione di filtrazione, con il design creato in SolidWorks e quindi stampato in 3D su una stampante 3D ProJet 3510 HD con materiale plastico VisiJet® M3-X. Le dimensioni del dispositivo erano limitate a causa delle dimensioni del tubo di centrifugazione richiesto per la depilazione.
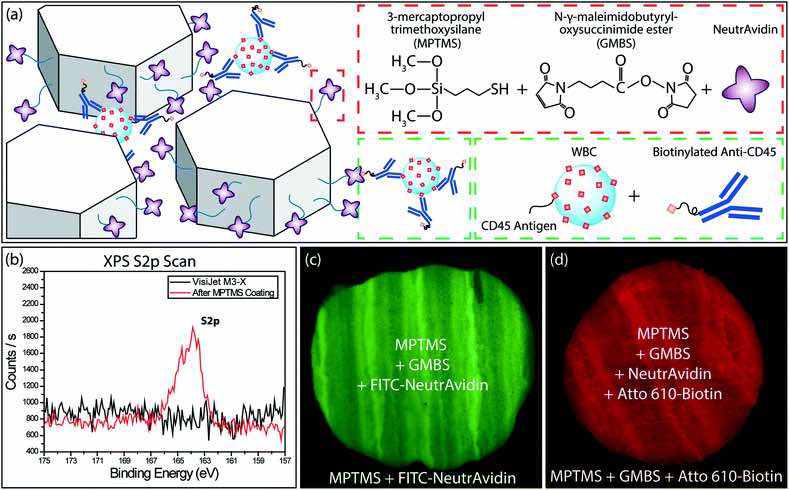
Funzionalizzazione superficiale del materiale stampato 3D e caratterizzazione. (a) Uno schema che mostra la funzionalizzazione della superficie (in alto a destra) e le sostanze chimiche per l’etichettatura del WBC (in basso a destra). (b) Risultati della scansione XPS di zolfo sulla superficie del materiale VisiJet® M3-X prima e dopo il rivestimento di MPTMS. Il picco conferma il successo del rivestimento. Immagini al microscopio a fluorescenza di (c) NeutrAvidin (FITC) e (d) biotina (Atto 610) su materiale VisiJet® M3-X modificato chimicamente. La fluorescenza differenziale tra la superficie funzionalizzata e la superficie di controllo esterna conferma la modifica specifica della superficie.
La stampa 3D ha permesso la fabbricazione più snella del dispositivo, soprattutto a causa del potenziale per una superficie più ampia; tuttavia, la tecnologia presentava anche un grosso problema nella necessità di eliminare la cera solida utilizzata come “riempitivo sacrificale” necessario.
“Abbiamo provato un sacco di modi diversi utilizzando strumenti medici tradizionali nei bio-laboratori e abbiamo finito con una centrifuga standard che rimuove la cera dura riscaldando la trappola e ruotandola per estrarre la cera liquida dai canali”, ha detto Sarioglu. “Questa è stata una sfida di produzione su cui abbiamo dovuto lavorare.”
Campioni simulati sono stati creati mentre “aggiungevano” le cellule tumorali nel sangue intero, principalmente coltivando la linea cellulare di carcinoma ovarico HeyA8, la linea cellulare di carcinoma mammario umano MDA-MB-231 (ATCC® HTB-26 ™) e la linea cellulare di carcinoma prostatico LNCaP (ATCC® CRL-1740 ™).
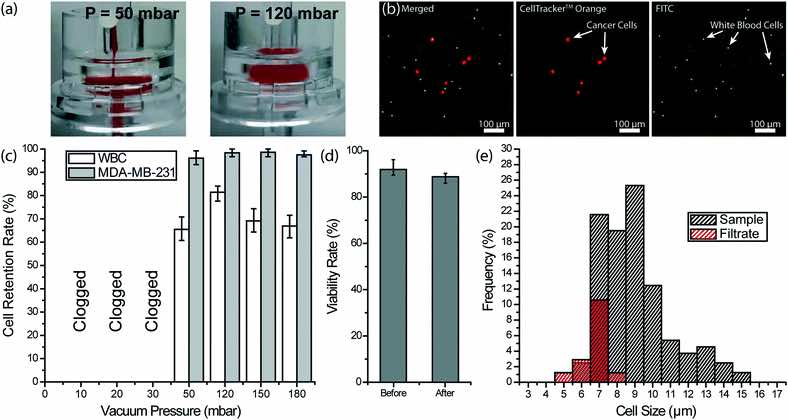
Rimozione di globuli rossi e piastrine dal sangue intero con un filtro a membrana. (a) Immagini di un filtro a membrana a pori di 3 μm operato a diverse pressioni tampone per recuperare cellule tumorali addizionate di sangue intero. (a sinistra) Quando il filtro veniva azionato a 50 mbar, si formava uno strato di torta a causa dell’accumulo di GR. (a destra) A 120 mbar, i globuli rossi si spremevano attraverso i pori in modo più efficiente e non si osservava nessuno strato di torta. (b) Immagini al microscopio a fluorescenza di cellule nucleate trattenute sul filtro. Le cellule tumorali al seno MDA-MB-231 sono state pre-colorate con CellTracker ™ Orange e i globuli bianchi sono stati etichettati con anticorpo anti-CD45 coniugato con FITC. (c) Percentuali di ritenzione misurate sia per le cellule di carcinoma mammario MDA-MB-231 a spillo che per i globuli bianchi sotto diverse pressioni di vuoto. (d) tasso di vitalità delle cellule tumorali MDA-MB-231 misurato prima e dopo l’elaborazione attraverso il filtro a membrana inferiore a 120 mbar. (e) Distribuzione misurata delle dimensioni delle cellule dei globuli bianchi nel campione e del filtrato a una pressione del vuoto di 120 mbar, dimostrando che nessun globulo di diametro superiore a 8 μm era in grado di passare attraverso il filtro a membrana.
La post-filtrazione del “sangue impoverito di leuco” ha permesso ai ricercatori di mantenere tutte le cellule nucleate, compresi i globuli bianchi rimasti sul filtro a membrana rimovibile. Nel complesso, il team vede il potenziale per ulteriori progressi e prestazioni ancora migliori nella loro tecnica scalabile.

Arricchimento delle cellule tumorali dal sangue intero utilizzando l’intero dispositivo. (a) Una foto dell’intero dispositivo stampato in 3D. Il dispositivo è riempito con coloranti di colore rosso e blu per visualizzare rispettivamente i percorsi di campionamento e buffer dedicati all’interno del dispositivo. (b) Immagini al microscopio a fluorescenza delle cellule nucleate trattenute sul filtro a membrana. Il colorante Hoechst 33342 è stato usato per colorare il nucleo cellulare. (c) Tassi di recupero misurati per le cellule tumorali ovariche (HeyA8), mammarie (MDA-MB-231) e prostatiche (LNCaP) addizionate a campioni di sangue intero. (d) Immagini al microscopio a fluorescenza del carcinoma prostatico CTC trattenute sul filtro a membrana.
“Questo è ciò per cui vivo in un certo senso: passi il tempo a pensare a qualcosa, lavori duramente per realizzarlo e alla fine lo vedi lavorare con l’idea che aiuterà le persone”, ha detto Sarioglu. “Ecco perché sono passato dalla semplice costruzione di strumenti sensibili e dispositivi di ingegneria a cose che possono aiutare le persone e avere un impatto sulla loro vita”.