TRIASTEK RICEVE L’AUTORIZZAZIONE FDA IND PER IL FARMACO STAMPATO IN 3D PER IL TRATTAMENTO DELL’ARTRITE REUMATOIDE
La società cinese di tecnologia farmaceutica e di stampa 3D Triastek ha ricevuto l’approvazione Investigational New Drug (IND) dalla Food and Drug Administration (FDA) statunitense per il suo primo prodotto farmaceutico stampato in 3D, T19.
T19 è stato sviluppato internamente ed è progettato per trattare l’artrite reumatoide, che è una malattia autoimmune in cui il sistema immunitario del corpo attacca per errore le cellule che rivestono le articolazioni, rendendole rigide e gonfie.
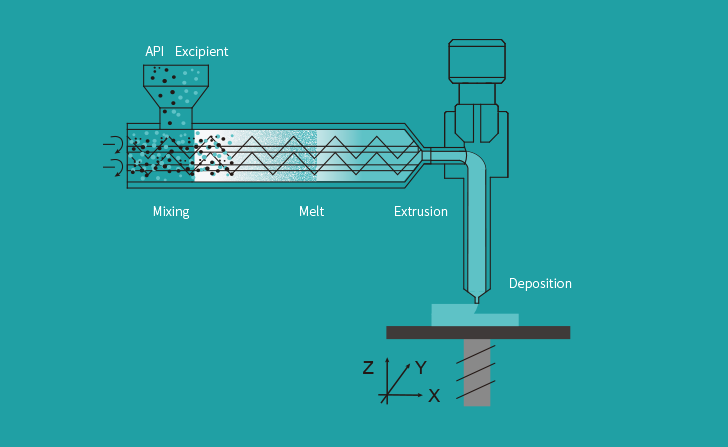
Triastek 3D ha stampato il prodotto farmaceutico utilizzando la sua piattaforma tecnologica Melt Extrusion Deposition (MED) e detiene i diritti di proprietà intellettuale (IP) globale sulla sua formulazione stampata in 3D.
“Triastek si impegna a migliorare l’efficienza dello sviluppo della formulazione, potenziare gli effetti dei prodotti farmaceutici e garantire la qualità del farmaco somministrato ai pazienti utilizzando la piattaforma tecnologica di stampa 3D”, ha affermato il dottor Senping Cheng, co-fondatore e CEO di Triastek . “L’autorizzazione FDA IND di T19 è una pietra miliare importante nello sviluppo e nell’applicazione della tecnologia di stampa 3D MED”.
La piattaforma tecnologica di stampa 3D MED di Triastek utilizza la progettazione di forme farmaceutiche digitali e la produzione intelligente automatizzata per consentire la costruzione di tablet con forme sofisticate e strutture geometriche interne. Queste strutture consentono di controllare e regolare attentamente il tempo di inizio, la durata e la modalità di somministrazione del farmaco, il che a sua volta fornisce risultati di somministrazione del farmaco più prevedibili e riproducibili.
Consentendo una maggiore personalizzazione dei farmaci stampati, il sistema MED può aiutare a migliorare gli effetti terapeutici dei farmaci, riducendo gli effetti collaterali e migliorando la compliance con i pazienti. Il nuovo metodo di sviluppo di prodotti farmaceutici di Triastek, 3D formulation by Design (3DFbD) può essere utilizzato in tandem con la tecnologia di stampa 3D MED per ridurre la necessità di tentativi ed errori spesso richiesti durante i tradizionali processi di sviluppo della formulazione. 3DFbD è progettato per migliorare sia l’efficienza che il tasso di successo dello sviluppo di prodotti farmaceutici di Triastek al fine di accelerare i tempi di sviluppo e ridurre i costi.
L’azienda ha anche integrato la tecnologia PAT (Process Analytical Technology) in tempo reale nel sistema MED che può monitorare continuamente il processo di stampa 3D per garantire la qualità del prodotto e rendere più conveniente il monitoraggio normativo.
Nell’aprile dello scorso anno, la piattaforma MED è stata accettata nell’Emerging Technology Program (ETP) della FDA che ha riconosciuto la tecnologia di stampa 3D come un processo completamente automatizzato per la produzione di forme di dosaggio orale solido a rilascio modificato.
“Riteniamo che la tecnologia di stampa 3D MED sarà il fattore abilitante per lo sviluppo di prodotti farmaceutici digitali e la produzione di farmaci intelligenti”, ha affermato il dott. Xiaoling Li, co-fondatore e CSO di Triastek. “Triastek collaborerà con tutte le parti interessate per trarre vantaggio dalla tecnologia della piattaforma per lo sviluppo di prodotti farmaceutici con un migliore valore clinico e una maggiore qualità del prodotto”.
Secondo Triastek, l’implementazione della stampa 3D per il nuovo design di T19 gli consente di funzionare come un sistema di somministrazione di farmaci cronoterapici. Il trattamento della cronoterapia si basa sull’idea che la somministrazione di farmaci in momenti diversi del ciclo circadiano – il naturale processo interno del corpo che regola il sonno nell’arco di 24 ore – massimizzerà l’impatto terapeutico di un farmaco riducendo al minimo gli effetti collaterali.
Il tablet T19 è stampato in 3D sul sistema MED di Triastek in una forma specifica e con una precisa struttura geometrica interna che facilita il controllo preciso del rilascio del farmaco per ottenere l’assorbimento desiderato da parte del paziente. Preso prima di coricarsi, il progetto di T19 significa che il farmaco verrà rilasciato in modo ritardato in modo che la concentrazione nel sangue raggiunga il picco quando i sintomi di dolore e rigidità articolare sono più acuti, come nelle prime ore del mattino.
Dopo aver ricevuto l’autorizzazione IND dalla FDA per T19, Triastek intende richiedere la stessa approvazione in Cina entro la fine dell’anno, seguita da domande in Giappone e in Europa. L’azienda prevede di presentare una nuova domanda di droga (NDA) per T19 alla FDA nel 2023 e ha annunciato di aver anche sviluppato un portafoglio di prodotti 505 (b) (2) utilizzando la tecnologia di stampa 3D MED per migliorare i risultati della terapia farmacologica.