TISSIUM RICEVE L’APPROVAZIONE DELLA FDA PER IL POLIMERO SIGILLANTE VASCOLARE
La società parigina TISSIUM MedTech ha ricevuto l’approvazione dalla Food and Drug Association (FDA) per la sua domanda di esenzione dai dispositivi sperimentali (IDE) per il suo sigillante vascolare.
L’approvazione dell’IDE apre la strada al lancio di una sperimentazione clinica negli Stati Uniti per il materiale, che fa parte della piattaforma polimerica proprietaria di TISSIUM per applicazioni terapeutiche.
“Siamo lieti di ricevere questa approvazione dalla FDA in quanto rappresenta una pietra miliare fondamentale che accelera lo sviluppo della nostra indicazione vascolare e innesca l’ulteriore espansione della nostra ampia piattaforma”, ha affermato Christophe Bancel, CEO di TISSIUM.
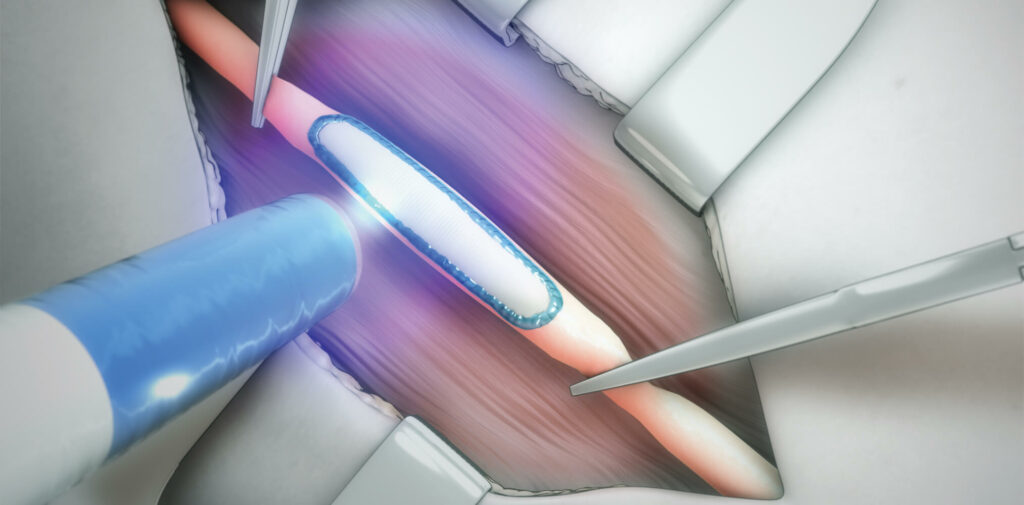
Progettato per l’uso negli interventi chirurgici vascolari periferici, il sigillante vascolare di TISSIUM è progettato per prevenire il sanguinamento post-operatorio e accelerare l’emostasi, il primo stadio della guarigione della ferita. Il polimero biocompatibile offre ai chirurghi un semplice processo di preparazione e applicazione, che integra l’uso di suture per favorire la completa chiusura chirurgica dei vasi vascolari.
Basato su un pre-polimero biocompatibile e biodegradabile, il poli (glicerolo sebacato acrilato), che viene attivato su richiesta tramite la luce, il sigillante vascolare può essere applicato in ambienti umidi e dinamici con un dilavamento minimo. Le proprietà biomorfiche del materiale gli consentono di conformarsi e integrarsi con il tessuto circostante per facilitare la ricostruzione del tessuto. Gli elementi costitutivi del polimero possono anche essere regolati per soddisfare i requisiti specifici del tessuto per varie applicazioni.
Il sigillante vascolare ha ricevuto il suo primo marchio CE nel 2017, più o meno nello stesso periodo in cui TISSIUM ha ampliato la sua piattaforma nella stampa 3D. Nel 2019 è stato concesso un ulteriore marchio CE per il sigillante in formato siringa preriempita.
La piattaforma del biopolimero di TISSIUM
L’approvazione IDE consentirà a TISSIUM di continuare ad espandere la sua piattaforma esistente di polimeri completamente sintetici, biomorfici e programmabili. La piattaforma utilizza una tecnologia proprietaria inizialmente sviluppata presso il Massachusetts Institute of Technology (MIT) e la Harvard Medical School dai professori Robert Langer e Jeffrey Karp, che hanno co-fondato TISSIUM nel 2013.
La tecnologia dei polimeri si basa su una combinazione di composti presenti in natura come glicerolo e acido sebacico. Un prepolimero viscoso può essere applicato con precisione ai tessuti durante le procedure chirurgiche, ottenendo uno spostamento minimo dei fluidi corporei. La luce blu visibile attiva il pre-polimero su richiesta per creare un legame adesivo ed elastico con il tessuto sottostante.
Il prepolimero può anche essere utilizzato come resina per costruire dispositivi stampati in 3D ad alta risoluzione. Attualmente, l’azienda sta lavorando allo sviluppo di scaffold chirurgici per la ricostruzione del nervo senza suture, combinando un dispositivo impiantabile stampato in 3D e un adesivo attivato su richiesta.
“Continueremo a mettere in atto la nostra strategia per costruire dispositivi utilizzando la nostra tecnologia polimerica di base e offrire applicazioni in più aree terapeutiche, come la riparazione dei nervi periferici e dell’ernia, dove abbiamo recentemente avviato lo sviluppo”, ha aggiunto Bancel.
TISSIUM detiene attualmente 18 brevetti e 26 in attesa di registrazione, il che suggerisce che ci sono molti altri sviluppi in arrivo dall’azienda.
La stampa 3D è stata utilizzata nel settore medico per la pianificazione e la preparazione di procedure chirurgiche per tempo. Gli esempi includono ricercatori dell’Università di Tampere che sperimentano un nuovo metodo di preparazione alla chirurgia nasale , l’uso di modelli stampati in 3D per praticare delicati interventi chirurgici da parte del Dipartimento di Chirurgia Vascolare dell’Ospedale Universitario di Mainz in Germania e nella preparazione di un’operazione di successo di nove ore. per separare i gemelli siamesi .
Più recentemente, l’esplorazione della stampa 3D per creare dispositivi medici per uso finale sta guadagnando maggiore trazione con il miglioramento delle proprietà e dei materiali di biocompatibilità. Ricercatori universitari turchi hanno valutato la fattibilità dell’utilizzo della tecnologia di bioprinting 3D per dispositivi potenzialmente impiantabili , mentre LOGEEKs Medical Systems (MS) ha annunciato il completamento di due operazioni chirurgiche utilizzando i suoi impianti personalizzati stampati in 3D .
Altrove, Children’s Healthcare di Atlanta e il Georgia Institute of Technology hanno utilizzato con successo stecche tracheali stampate in 3D nella chirurgia pediatrica di un paziente di 7 mesi, mentre le protesi mammarie stampate in 3D da BellaSeno hanno ottenuto la certificazione ISO 13485 e hanno iniziato gli studi clinici lo scorso anno.
Più recentemente, l’ Istituto Federale Svizzero di Tecnologia di Losanna ha sviluppato un microdispositivo meccanico in grado di eseguire biopsia e somministrazione di farmaci quando impiantato nella pelle umana e 4WEB Medical ha aggiunto un sistema di traliccio per colonna vertebrale anteriore autonomo al suo portafoglio di impianti spinali stampati in 3D.